题目内容
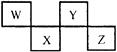
(15分)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
(1)写出各元素的名称:
X ,Y , Z ,W 。
(2)X在元素周期表中的位置: 。
(3)X和W形成的化合物电子式为: 。
(4)写出X的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物反应的化学方程式: 。
(1)写出各元素的名称:
X ,Y , Z ,W 。
(2)X在元素周期表中的位置: 。
(3)X和W形成的化合物电子式为: 。
(4)写出X的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物反应的化学方程式: 。
(1)X 钠 Y 碳 Z 氮 W 氯 各2分
(2)第三周期IA族 2分 (3) 2分
2分
(4)NaOH+HNO3=NaNO3+H2O 3分
(2)第三周期IA族 2分 (3)
 2分
2分(4)NaOH+HNO3=NaNO3+H2O 3分
(1)Y与Z的原子次外层的电子数均为2,所以根据最高价可知,Y是C,Z是N。W、X的原子次外层的电子数均为8,则W是Cl,X是Na。
(2)钠的原子序数是11,因此位于第三周期第IA族。
(3)钠和氯形成含有离子键的离子化合物NaCl,电子式为 。
。
(40X的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物分别是氢氧化钠和硝酸,二者发生中和反应,方程式为NaOH+HNO3=NaNO3+H2O。
(2)钠的原子序数是11,因此位于第三周期第IA族。
(3)钠和氯形成含有离子键的离子化合物NaCl,电子式为
 。
。(40X的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物分别是氢氧化钠和硝酸,二者发生中和反应,方程式为NaOH+HNO3=NaNO3+H2O。

练习册系列答案
相关题目