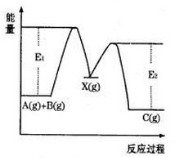
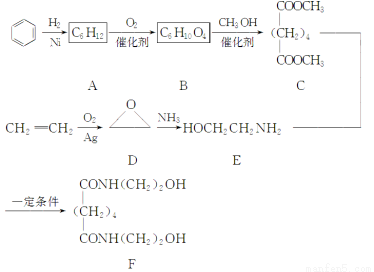
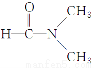
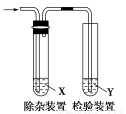
题目内容
亚硫酸盐是一种常见食品添加剂。为检测某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计)。某研究小组设计了如下两种实验流程:
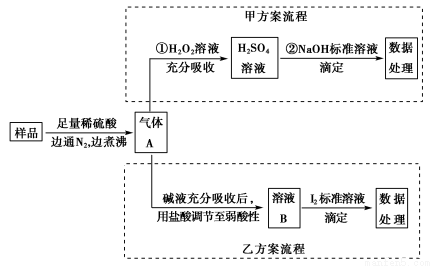
(1)气体A的主要成分是________。为防止煮沸时发生暴沸,必须先向烧瓶中加入________;通入N2的目的是________。
(2)写出甲方案第①步反应的离子方程式:________________________。
(3)甲方案第②步滴定前,滴定管需用NaOH标准溶液润洗,其操作方法是__________________________________________________________。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果________(填“偏高”“偏低”或“无影响”)。
(5)若取样品w g,按乙方案测得消耗0.010 00 mol·L-1I2溶液V mL,则1 kg样品中含SO2的质量是________g(用含w、V的代数式表示)。
(1)N2和SO2 碎瓷片(或沸石) 使产生的SO2全部逸出
(2)SO2+H2O2=2H++SO42—
(3)向滴定管注入少量标准液,倾斜转动滴定管润洗全部内壁后从尖嘴放出液体,重复操作2~3次
(4)无影响
(5)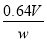
【解析】 (1)亚硫酸盐中加入强酸会生成气体SO2,反应的离子方程式为SO32—+2H+=SO2↑+H2O;在加热
时为了防止暴沸应加入碎瓷片,通入N2的目的是将产生的SO2气体完全吹出后用吸收液吸收,从而提高实验的准确率。
(2)SO2具有还原性,能被H2O2氧化成H2SO4,反应的离子方程式为SO2+H2O2=2H++SO42—。
(3)滴定管在洗涤后应用NaOH标准液润洗,方法是:向滴定管注入少量标准液,倾斜转动滴定管润洗全部内壁后从尖嘴放出液体,重复操作2~3次。
(4)如果用盐酸代替稀硫酸,在逸出的SO2气体中会含有HCl气体,两者都能被碱液吸收分别生成Na2SO3和NaCl,再用盐酸处理后只有Na2SO3转变成的NaHSO3能与I2反应,反应的离子方程式为HSO3—+I2+H2O=SO42—+2I-+3H+,故不会产生影响。
(5)根据关系式SO2~HSO3—~I2,则1 kg样品中含有SO2的质量为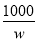 ×V×10-3×0.010 00×64 g=
×V×10-3×0.010 00×64 g=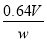 g。
g。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案