题目内容
【题目】反应aA(g)+bB(g)![]() cC(g) (ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g) (ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
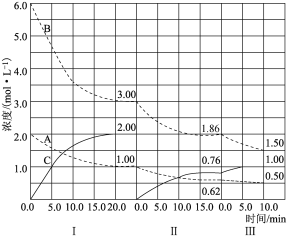
(1)第Ⅰ阶段达平衡时的平衡常数K=___。
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从小到大排列次序为___;
(3)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最大的是___;
(4)由第Ⅰ阶段平衡到第Ⅱ阶段平衡,平衡移动的方向是___,采取的措施是___;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3(填“>”“<”“=”),判断的理由是___。
【答案】![]() vⅢ(A)、vⅡ(A)、vⅠ(A) αⅠ(B) 向正反应方向 从反应体系中移出产物C > 此反应为放热反应,降低温度,平衡向正反应方向移动
vⅢ(A)、vⅡ(A)、vⅠ(A) αⅠ(B) 向正反应方向 从反应体系中移出产物C > 此反应为放热反应,降低温度,平衡向正反应方向移动
【解析】
(1)由图第Ⅰ阶段,达到平衡时各物质的浓度,根据平衡常数=![]() 计算
计算
(2)根据化学反应速率为单位时间浓度的变化值,可计算三个阶段用A表示的化学反应速率,据此判断;
(3)转化率是物质的减少量与初始量的比值,计算三个阶段B的转化率,据此解答;
(4)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
(5) 第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低。
(1)由图可知第Ⅰ阶段,平衡时△c(A)=2mol/L-1mol/L=1mol/L,△c(B)=6mol/L-3mol/L=3mol/L,△c(C)=2mol/L,浓度变化量之比等于化学计量数之比,故a:b:c=1mol/L:3mol/L:2mol/L=1:3:2, A(g)+3B(g)![]() 2C(g),根据平衡常数=
2C(g),根据平衡常数=![]() =
=![]() =
=![]() ;
;
(2)vⅠ(A)=![]() =0.05mol/(Lmin),vⅡ(A)=
=0.05mol/(Lmin),vⅡ(A)=![]() =0.0253mol/(Lmin),
=0.0253mol/(Lmin),
vⅢ(A)=![]() =0.012mol/(Lmin),故A的平均反应速率vⅠ(A)>vⅡ(A)>vⅢ(A);
=0.012mol/(Lmin),故A的平均反应速率vⅠ(A)>vⅡ(A)>vⅢ(A);
(3)B的平衡转化率αⅠ(B)=![]() ×100%=50%,αⅡ(B)=
×100%=50%,αⅡ(B)=![]() ×100%=38%,
×100%=38%,
αⅢ(B)=![]() ×100%=19.4%,则B的转化率最大的为αⅠ(B);
×100%=19.4%,则B的转化率最大的为αⅠ(B);
(4)第Ⅱ阶段C是从0开始的,瞬间A、B浓度不变,因此可以确定第一次平衡后从体系中移出了C,即减少生成物浓度,平衡正向移动;
(5)第Ⅲ阶段的开始与第Ⅱ阶段的平衡各物质的量均相等,根据A、B的量减少,C的量增加可判断平衡是正向移动的,根据平衡开始时浓度确定此平衡移动不可能是由浓度的变化引起的,另外题目所给条件容器的体积不变,则改变压强也不可能,因此一定为温度的影响,此反应正向为放热反应,可以推测为降低温度,另外结合A的速率在三个阶段的情况,确定改变的条件一定为降低温度,根据勒夏特列原理,平衡的移动只能减弱改变,不能抵消改变,因此达到平衡后温度一定比第Ⅱ阶段平衡时的温度低。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案