题目内容
【题目】下表是元素周期表的一部分,表中所列的数字序号分别代表一种化学元素
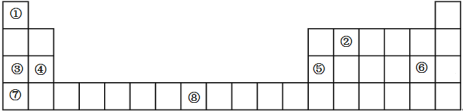
试回答下列问题:
(1)请画出⑧号元素的基态原子价电子排布图_________________________。
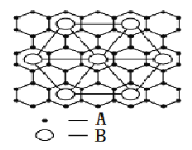
(2)②号元素(用A表示)形成的一种同素异形体与熔融的⑦号元素(用B表示)形成单质形成A元素间隙化合物,比较常见的A元素间隙化合物是青铜色的化合物,其化学式可写作Ax B,其平面图形见图,则x值为____________。
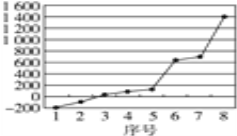
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_______(填元素符号);其中电负性最大的是______(填图中的序号)(稀有气体除外)。
(4)⑤号元素形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
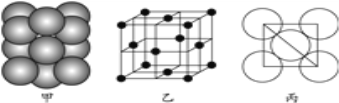
若已知⑤号元素原子半径为d cm,NA代表阿伏加德罗常数,该元素的相对原子质量为M,则该晶体的密度为____________ g·cm-3(用字母表示)。
【答案】 略 8 Si 2 ![]()
【解析】本题考查物质结构与性质,涉及核外电子排布、晶胞结构与计算、元素周期律、晶体类型与单质熔沸点的关系等知识点,晶胞计算中关键问题是确定晶胞的棱长。
根据元素周期表的结构分析,①为氢,②为碳,③为钠,④为镁,⑤为铝,⑥为氯,⑦为钾,⑧为铁。(1)铁元素的基态原子价电子排布图为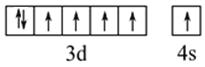 。(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个钾为6个小三角形共用,占有的钾原子数为
。(2)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,每个钾为6个小三角形共用,占有的钾原子数为![]() ,故碳原子数和钾原子数之比是4:
,故碳原子数和钾原子数之比是4:![]() =8,故x=8。(3)第三周期8种元素中的单质中只有硅为原子晶体,熔沸点最大,由图可知序号“8”代表的为硅,同周期随原子序数增大,电负性增大,故氯元素电负性最大,氯气的沸点仅高于氩,故序号为“2”的为氯。(4)由晶胞结构可知,晶胞中铝原子的数目为
=8,故x=8。(3)第三周期8种元素中的单质中只有硅为原子晶体,熔沸点最大,由图可知序号“8”代表的为硅,同周期随原子序数增大,电负性增大,故氯元素电负性最大,氯气的沸点仅高于氩,故序号为“2”的为氯。(4)由晶胞结构可知,晶胞中铝原子的数目为![]() ,该晶胞中原子的质量是
,该晶胞中原子的质量是![]() ,由信息可知晶胞图可知为面心立方,铝原子半径为dcm,由图丙可知,晶胞的棱长为
,由信息可知晶胞图可知为面心立方,铝原子半径为dcm,由图丙可知,晶胞的棱长为![]() ,故晶胞的体积为
,故晶胞的体积为![]() ,所以其密度为
,所以其密度为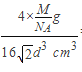 =
=![]() 。
。



