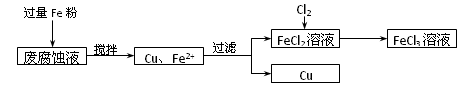
题目内容
(14分)制印刷电路的废液含有大量CuCl2、FeCl2和FeCl3,测得某废腐蚀液中含CuCl21.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验,

回答下列问题:
(1)用上述方法获得的铜粉中含有杂质,除杂所需试剂是__________;检验废腐蚀液中含有存在Fe2+的方法是______________________(注明试剂、现象)。
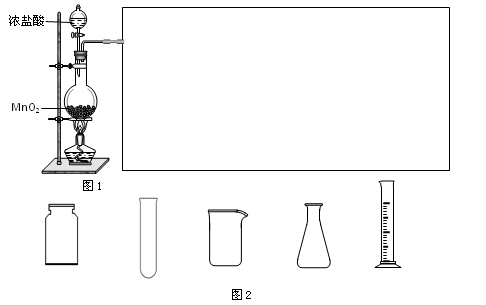
(2)实验室可用浓盐酸和固体MnO2反应制备Cl2。此反应中体现了盐酸的_________性质,反应的离子方程式为____________________。
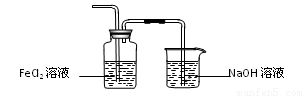
利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。请从图2中挑选所需的仪器,完成图1中的装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。

(3)按上述流程操作,需称取Fe粉的质量应不少于_____________g,需通入Cl2的物质的量不少于_______________mol。
(14分)(每空2分)
(1) 稀盐酸 取少量腐蚀液,滴加KMnO4溶液,KMnO4溶液退色
(2) MnO2+4H+ +2Cl—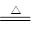 Mn2+ +C12↑+2H2O 酸性和还原性
Mn2+ +C12↑+2H2O 酸性和还原性
(3) 39.2 0.75
【解析】(1)由于加入的铁粉是过量的,所以得到的铜中一定含有铁,除去多余的铁粉,可以利用稀盐酸;亚铁离子具有还原性,据此可以鉴别,即取少量腐蚀液,滴加KMnO4溶液,KMnO4溶液退色。
(2)实验室制取氯气的方程式是 MnO2+4H+ +2Cl—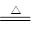 Mn2+ +C12↑+2H2O,根据方程式可知,氯元素的化合价升高,依次氯化氢是还原剂。另外还有氯化锰生成,元素浓盐酸还起酸性作用,即体现了浓盐酸的酸性和还原性。
Mn2+ +C12↑+2H2O,根据方程式可知,氯元素的化合价升高,依次氯化氢是还原剂。另外还有氯化锰生成,元素浓盐酸还起酸性作用,即体现了浓盐酸的酸性和还原性。
(3)由于氯气有毒,所以必须有尾气处理装置,可以利用氢氧化钠溶液吸收多余的氯气。
(4)200ml腐蚀液中含有铁离子是0.2mol、铜离子是0.3mol、氢离子是0.6mol,则分别消耗铁的物质的量是0.1mol、0.3mol和0.3mol,所以至少需要加入铁粉的质量是0.7mol×56g/mol=39.2g。此时溶液中共计含有亚铁离子的物质的量是0.7mol+0.2mol+0.6mol=1.5mol,所以至少需要通入氯气0.75mol。