题目内容
12.对于0.1mol•L-1的Na2S溶液,下列判断正确的是( )| A. | 向溶液加入少量NaOH固体,能促进水的电离 | |
| B. | c(Na+)=2c(S2-)+c(OH-)+c(HS-) | |
| C. | c(Na+)=c(S2-)+c(HS-) | |
| D. | 溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
分析 A.向溶液中加入少量NaOH固体,抑制水的电离;
B.根据混合液中的核电荷数判断;
C.根据硫化钠溶液中的物料守恒分析;
D.Na2S溶液存在S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,第一步水解程度大于第二步水解.
解答 解:A.向溶液中加入少量NaOH固体,c(OH-)增大,抑制水的电离,故A错误;
B.硫化钠溶液存在电荷守恒:c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-),故B错误;
C.根据溶液中的物料守恒可得:c(Na+)=c(S2-)+c(HS-)+c(H2S),故C错误;
D.Na2S溶液存在S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,则有c(OH-)>c(HS-),一般来说水解程度较小,则应有c(S2-)>c(OH-)>c(HS-),故D正确;
故选D.
点评 本题考查离子浓度大小的比较,题目难度中等,注意从电荷守恒、物料守恒的角度分析,把握盐类水解的原理,易错点为D,试题侧重考查学生达到分析、理解能力.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
7.在NaIO3的碱性溶液中通入氯气,可以得到Na2H3IO6.下列说法错误的是( )
| A. | 在该反应中NaIO3作还原剂 | |
| B. | 碱性条件下,Na2H3IO6氧化性强于氯气 | |
| C. | 反应中生成1mol Na2H3IO6,转移2mol电子 | |
| D. | 反应中氧化产物与还原产物的物质的量之比为1:2 |
17.下列说法不正确的是( )
| A. | 不慎碰倒酒精灯,洒出的酒精在桌面上燃烧,应立即用湿抹布盖灭 | |
| B. | 眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 | |
| C. | 万一发生着火,要沉着快速处理,首先要切断热源、电源,移走附近的可燃物,再针对燃烧物的性质选用湿抹布、干沙土、水、泡沫灭火器、二氧化碳灭火器、1211灭火器等来进行灭火 | |
| D. | 给试管里的液体加热时,液体的体积不超过其容积的2/3 |
4.设NA为阿佛加德罗常,下列叙述正确的是( )
| A. | 在100mL0.5mol/LCH3COOH溶液中CH3COOH分子数等于0.05NA | |
| B. | 在标况下,22.4L辛烷含共价键数为25NA | |
| C. | 已知PbI2的KSP=7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为5.6×10-4 mol/L | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-数目为0.2NA |
1.相同温度的下列溶液:①0.1mol•L-1的硫酸 ②0.01mol•L-1的NaOH溶液,其中由水电离产生的[H+]之比为( )
| A. | 1:1 | B. | 1:10 | C. | 1:20 | D. | 20:1 |
2.砹(At)是卤族元素中位于碘之后的元素,试推测砹和砹的化合物最不可能具有的性质是( )
| A. | 砹易溶于某些有机溶剂 | B. | HAt很不稳定,易分解 | ||
| C. | 砹是有色固体,分子式为At2 | D. | AgAt难溶于水,可溶于稀HNO3 |
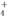 )=c(Cl-)
)=c(Cl-)