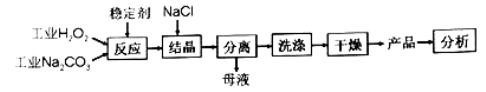
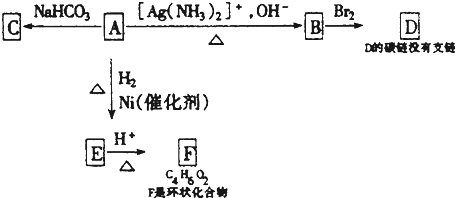
��Ŀ����
����Ŀ����ϩ(C2H4)������(C2H6)�Ļ�����干amol����bmolO2������һ�ܱ������У���ȼ���ַ�Ӧ����ϩ������ȫ�������꣬�õ�CO��CO2�Ļ�������45gH2O������
(1)��a��1ʱ����ϩ����������ʵ���֮��n(C2H4):n(C2H6)�� ��
(2)��a��1���ҷ�Ӧ��CO��CO2�Ļ����������ʵ���Ϊ��ӦǰO2��2/3ʱ��b�� ���õ���CO��CO2�����ʵ���֮��n(CO)��n(CO2)�� ��
(3)a��ȡֵ��Χ�� ��
���𰸡�(1)l : l (2)3 1:3 (3)![]() <a<
<a<![]()
��������
���������(1)��C2H4��C2H6�����ʵ����ֱ�Ϊx��y����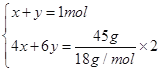
![]()
����n(C2H4)��n(C2H6)��1��1��
(2)��CO��CO2�����ʵ����ֱ�Ϊm��n����m��n��2 mol����O2�����ʵ���b��![]() ��3 mol��
��3 mol��
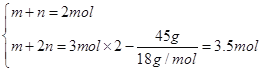
![]()
����n(CO)��n(CO2)��1��3��
(3)��a mol����ȫΪC2H4����4a mol��![]() ��2��5 mol��a��
��2��5 mol��a��![]() ����a mol����ȫΪC2H6����6a mol��
����a mol����ȫΪC2H6����6a mol��![]() ��2��5 mol��a��
��2��5 mol��a��![]() ������
������![]() <a<
<a<![]() ��
��

��ϰ��ϵ�д�
 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
�����Ŀ