题目内容
下列有关一定物质的量浓度的溶液配制的过程中,造成所得的溶液浓度偏大的是( )。
| A.要配制100 mL 1 mol·L-1 NaOH溶液,需在白纸上称4 g NaOH固体,并且称量速度较慢 |
| B.称量时托盘天平的砝码已被锈蚀 |
| C.溶解或稀释溶质时烧杯尚未干燥 |
| D.定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线 |
B
解析

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,15 g甲基(-CH3)所含的电子数为7NA |
| B.水的摩尔质量就是NA个水分子的质量之和 |
| C.含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| D.1 mo1Mg与足量O2或N2反应生成MgO或Mg3 N2均失去2NA个电子 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.3mol NO2与水充分反应,转移nA个电子 |
| B.常温常压下,18g H2O含有3nA个原子 |
| C.1L 0.1 mol·L-1NaHCO3溶液中含有0.1nA个HCO3- |
| D.标准状况下,2.24L乙醇含有0.1nA个CH3CH2OH分子 |
设NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.1 L1 mol/L氯化铜溶液中含有NA个Cu2+ |
| B.标准状况下,22.4 L O2参加任何化学反应转移的电子数都是4NA |
| C.1 mol Zn与足量稀HNO3反应,转移2NA个电子 |
| D.1 mol H3O+所含电子数为8NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.24 g NaH中阴离子所含电子总数为NA |
| B.标准状况下,22.4 L苯中含有C—H键数目为6NA |
C.在碳酸钠溶液中,若c(C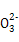 )="1" mol/L,则c(Na+)="2" mol/L )="1" mol/L,则c(Na+)="2" mol/L |
| D.通过MnO2催化使H2O2分解,产生32 g O2时转移电子数为2NA |
在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中K+的浓度约是(忽略溶液中少量的H+和OH-)( )。
| A.0.125 mol·L-1 | B.0.225 mol·L-1 |
| C.0.250 mol·L-1 | D.0.450 mol·L-1 |
下列变化中不属于化学变化的是( )。
| A.油脂的硬化 |
| B.S8受热后变为S2 |
| C.水泥制作水泥混凝土 |
D.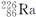 ―→ ―→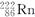 +He +He |
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A.1 mol NaHSO4晶体含有2NA个离子 |
| B.1 L 2 mol/L明矾溶液经水解可得到氢氧化铝胶体粒子的数目为2NA |
C.1 mol C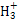 (碳正离子)中含有的电子数为10NA (碳正离子)中含有的电子数为10NA |
| D.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA |