题目内容
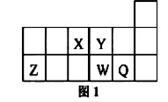
右表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是


| A.常温常压下,五种元素的单质中有两种是气态 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物比X的氢化物稳定 |
| D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者 |
A
试题分析:根据元素周期表的结构以及元素在周期表中的相对位置可知,若R为稀有气体元素,则X是N、W是P、Y是S、R是Ar、Z是Br。A、常温常压下,五种元素的单质中有两种是气态,分别是氩气和氮气,S和P是固态,单质溴是液态,A正确;B、S2-与Ar的电子层结构相同,都是18e-,但Br-是36e-微粒,与Ar的电子层结构不同,B不正确;C、同主族自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,所以X的氢化物比W的氢化物稳定,C不正确;D、同周期自左向右非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,所以Y与W元素的最高价氧化物对应的水化物的酸性比较,前者强于后者,D不正确,答案选A。

练习册系列答案
 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
 HCNO + NH3(已配平)。完成下列填空:
HCNO + NH3(已配平)。完成下列填空: 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)