题目内容
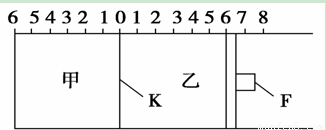
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
A.甲中气体的总压强不变 B.各气体的物质的量浓度不变
C.混合气体的平均摩尔质量不变 D.混合气体的密度不变
E.反应速率v(SO2)=v(SO3)
(2)达到平衡后隔板K是否可能处于0刻度 ________(填“可能”或“不可能”)。若K最终停留在0刻度左侧a处,则a一定小于________。
(3)若平衡时,K最终停留在左侧刻度1处,则甲中SO3的物质的量为________mol,乙中SO3的转化率________50%(填“>”、“<”或“=”),活塞F最终停留在右侧刻度______处(填下列序号:①<6 ②>6 ③=6)。
(4)若一开始就将K、F固定,其他条件均不变,甲平衡后压强变为开始压强的0.8倍,则甲、乙都达到平衡后,两容器的压强之比为P甲:P乙=
21.(1)ABC (2)不可能 2 (3) 1, >, ② (4) 12:17
【解析】
试题分析:(1)若固定隔板K,甲容器相当于恒温恒容的容器,当各物质的物质的量(气体的总压强不变),各气体的物质的量浓度不变,混合气体的平均摩尔质量不变时达到平衡状态。 而混合气体的密度不变始终不变;反应速率v(SO2) v(SO3),没有指明是正反应速率还是逆反应速率 ,所以ABC正确。
(2)2SO2(g)+O2(g)⇌2SO3(g),反应是气体体积减小的反应,隔板一定发生滑动,达到平衡后隔板K不可能处于0刻度;由于甲中充入2molSO2和1mol O2,反应向正反应方向移动,A中压强降低,最多能转化为2mol SO3,但是由于反应是可逆反应,所以SO3的物质的量在0-2 mol之间,所以达到平衡后,隔板K不再滑动,最终停留在左侧刻度0-2之间,故a小于2;
(3)由于左右两边不考虑加入的氦气,达到的平衡是相同平衡,三氧化硫体积分数相同,“隔板K最终停留在左侧1处”说明反应后气体体积为5格,左边气体减少了0.5mol,即平衡后物质的量为2.5mol,
设参加反应的二氧化硫的物质的量为2x,
故2-2x+1-x+2x=2.5,
则x=0.5mol,
则甲中二氧化硫的转化率为50%.生成三氧化硫物质的量为1mol;
但是对于乙来说,就不同了,如果无He,甲与乙是等效平衡,但乙的压强比甲小,则2SO3(g)⇌2SO2(g)+O2(g)的平衡向右移动了,故其转化率比大于50%;左边气体减少了0.5mol,右边增加物质的量大于0.5mol,F活塞右移,活塞F最终停留在右侧刻度大于6处;
故答案为:1,>,②;
(3)体积固定,恒温、恒压容器中,两边达到平衡的状态相同,乙中的氦气对平衡无影响;甲平衡后压强变为开始压强的0.8倍,即平衡后甲容器中气体2.4 mol,乙容器中气体3.4 mol,所以压强之比12:17
考点:化学平衡的计算;化学平衡建立的过程.

 中考解读考点精练系列答案
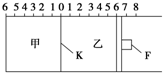
中考解读考点精练系列答案如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)
|

A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
B.达到平衡后,隔板K最终停留在左侧刻度0~2之间
C.到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量
D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处
 如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题:
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2mol SO2和1mol O2,乙中充入2mol SO3和1mol He,此时K停在0处.在一定条件下发生可逆反应:2SO2(g)+O2(g)?2SO3(g),反应达到平衡后,再恢复至原温度.回答下列问题: (2010?平顶山模拟)如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)
(2010?平顶山模拟)如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度.
2C(g),反应达到平衡后,恢复到反应发生前时的温度.