题目内容
【题目】已知图一表示的是可逆反应A(g)+B(g)![]() C(s)+D(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+D(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
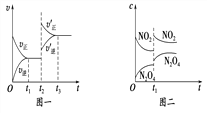
A. 若图一t2时改变的条件是增大压强,则反应的ΔH增大
B. 图一t2时改变的条件可能是升高了温度或增大了压强
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
【答案】B
【解析】A、△H只与始态和终态有关,与反应途径无关,增大压强,△H不变,故错误;B、正反应是吸热反应,升高温度,平衡向正反应方向进行,根据图一,t2时刻反应向正反应方向进行,升高温度,符合图像,反应前气体系数之和大于反应后气体系数,增大压强,平衡向正反应方向移动,符合图像一,故正确;C、图二,NO2和N2O4的浓度都增大,升高温度不能达到此效果,增大压强,组分浓度增大,平衡向正反应方向移动,符合图像二,因此应是增大压强,故错误;D、增大压强,平衡向正反应方向移动,分子量从46→92变化,平均相对分子质量增大,故错误。

练习册系列答案
相关题目