题目内容
NA表示阿伏加德罗常数的值,下列说法不正确的是
- A.10g质量分数为46%的乙醇溶液中,氧原子总数为0.4NA
- B.92g C3H8O3和C7H8的混合物,完全燃烧生成H2O分子为4NA
- C.0.1 mol石墨晶体中存在的C-C键数目为0.2NA
- D.18g 重水(D216O)所含质子数为9NA
C
分析:A、根据质量分数计算乙醇与水的质量,根据n= 计算乙醇和水的物质的量,每个乙醇分子和水分子都含有1个氧原子,
计算乙醇和水的物质的量,每个乙醇分子和水分子都含有1个氧原子,
计算氧原子物质的量,根据N=nNA计算氧原子数目.
B、C3H8O3和C7H8中氢元素的质量分数相同,所以混合物氢元素质量分数是定值为 ,据此计算氢元素质量,根据n=
,据此计算氢元素质量,根据n= 计算氢原子的物质的量,根据氢原子守恒计算水的物质的量,根据N=nNA计算水分子数目.
计算氢原子的物质的量,根据氢原子守恒计算水的物质的量,根据N=nNA计算水分子数目.
C、石墨晶体中邻近的三个碳原子形成三个共价单键并排列成平面六角的网状结构,这些网状结构以范德华力联成互相平行的平面,构成层状结构结构,每个共价键给碳原子提供 .
.
D、根据n= 计算重水的物质的量,每个水分子含有10个质子,根据N=nNA计算质子数目.
计算重水的物质的量,每个水分子含有10个质子,根据N=nNA计算质子数目.
解答:A、10g质量分数为46%的乙醇溶液中,乙醇的质量为4.6g,物质的量为0.1mol,水的质量为10g-4.6g=5.4g,物质的量为0.3mol,每个乙醇分子和水分子都含有1个氧原子,所以含有氧原子数目为(0.1mol+0.3mol)×NAmol-1=0.4NA,故A正确;
B、C3H8O3和C7H8中氢元素的质量分数相同,所以混合物氢元素质量分数是定值为 ,所以92gC3H8O3和C7H8的混合物中氢元素的质量为92g×
,所以92gC3H8O3和C7H8的混合物中氢元素的质量为92g× =8g,氢原子的物质的量为
=8g,氢原子的物质的量为 =8mol,所以生成水的物质的量为4mol,水分子数目为4mol×NAmol-1=4NA,故B正确;
=8mol,所以生成水的物质的量为4mol,水分子数目为4mol×NAmol-1=4NA,故B正确;
C、石墨晶体中邻近的三个碳原子形成三个共价单键并排列成平面六角的网状结构,这些网状结构以范德华力联成互相平行的平面,构成层状结构结构,每个共价键给碳原子提供 ,0.1mol石墨晶体中存在的C-C键数目为0.1mol×3×
,0.1mol石墨晶体中存在的C-C键数目为0.1mol×3× ×NAmol-1=0.15NA,故C错误;
×NAmol-1=0.15NA,故C错误;
D、18g重水(D216O)的物质的量为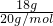 =0.9mol,每个水分子含有10个质子,所以含有质子数为0.9mol×10×NAmol-1=9NA,故D正确.
=0.9mol,每个水分子含有10个质子,所以含有质子数为0.9mol×10×NAmol-1=9NA,故D正确.
故选:C.
点评:考查常用化学计量有关计算,难度中等,B选项关键确定混合物中氢元素质量分数,C选项为易错点,清楚石墨晶体结构,根据均摊法计算共价键数目.
分析:A、根据质量分数计算乙醇与水的质量,根据n=
 计算乙醇和水的物质的量,每个乙醇分子和水分子都含有1个氧原子,
计算乙醇和水的物质的量,每个乙醇分子和水分子都含有1个氧原子,计算氧原子物质的量,根据N=nNA计算氧原子数目.
B、C3H8O3和C7H8中氢元素的质量分数相同,所以混合物氢元素质量分数是定值为
 ,据此计算氢元素质量,根据n=
,据此计算氢元素质量,根据n= 计算氢原子的物质的量,根据氢原子守恒计算水的物质的量,根据N=nNA计算水分子数目.
计算氢原子的物质的量,根据氢原子守恒计算水的物质的量,根据N=nNA计算水分子数目.C、石墨晶体中邻近的三个碳原子形成三个共价单键并排列成平面六角的网状结构,这些网状结构以范德华力联成互相平行的平面,构成层状结构结构,每个共价键给碳原子提供
 .
.D、根据n=
 计算重水的物质的量,每个水分子含有10个质子,根据N=nNA计算质子数目.
计算重水的物质的量,每个水分子含有10个质子,根据N=nNA计算质子数目.解答:A、10g质量分数为46%的乙醇溶液中,乙醇的质量为4.6g,物质的量为0.1mol,水的质量为10g-4.6g=5.4g,物质的量为0.3mol,每个乙醇分子和水分子都含有1个氧原子,所以含有氧原子数目为(0.1mol+0.3mol)×NAmol-1=0.4NA,故A正确;
B、C3H8O3和C7H8中氢元素的质量分数相同,所以混合物氢元素质量分数是定值为
 ,所以92gC3H8O3和C7H8的混合物中氢元素的质量为92g×
,所以92gC3H8O3和C7H8的混合物中氢元素的质量为92g× =8g,氢原子的物质的量为
=8g,氢原子的物质的量为 =8mol,所以生成水的物质的量为4mol,水分子数目为4mol×NAmol-1=4NA,故B正确;
=8mol,所以生成水的物质的量为4mol,水分子数目为4mol×NAmol-1=4NA,故B正确;C、石墨晶体中邻近的三个碳原子形成三个共价单键并排列成平面六角的网状结构,这些网状结构以范德华力联成互相平行的平面,构成层状结构结构,每个共价键给碳原子提供
 ,0.1mol石墨晶体中存在的C-C键数目为0.1mol×3×
,0.1mol石墨晶体中存在的C-C键数目为0.1mol×3× ×NAmol-1=0.15NA,故C错误;
×NAmol-1=0.15NA,故C错误;D、18g重水(D216O)的物质的量为
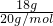 =0.9mol,每个水分子含有10个质子,所以含有质子数为0.9mol×10×NAmol-1=9NA,故D正确.
=0.9mol,每个水分子含有10个质子,所以含有质子数为0.9mol×10×NAmol-1=9NA,故D正确.故选:C.
点评:考查常用化学计量有关计算,难度中等,B选项关键确定混合物中氢元素质量分数,C选项为易错点,清楚石墨晶体结构,根据均摊法计算共价键数目.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目