题目内容
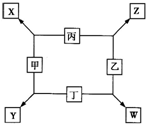
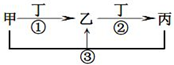
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.请回答下列问题:
(1)X中化学键类型为______.实验室制备W的化学方程式为______ CaCl2+2NH3↑+2H2O
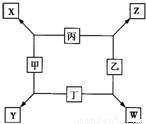
【答案】分析:X由两种短周期元素组成的化合物,且为淡黄色固体,则X为Na2O2;Z遇空气变为红棕色,则Z为NO;W能使湿润的红色石蕊试纸变蓝色,则W为NH3;结合转化关系,可以推知丙为O2,甲为Na,乙为N2,丁为H2,钠是活泼金属,氢气是活泼非金属,二者可以化合生成离子化合物NaH,故Y为NaH.
(1)Na2O2属于离子化合物,过氧根离子中氧原子之间形成非极性键;
实验室制备氨气通常利用氯化铵与氢氧化钙,在加热的条件下制备,反应生成氯化钙、氨气与水;
(2)将钠投入氯化铁溶液中,钠首先与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铁反应生成氢氧化铁红褐色沉淀;
(3)①氨气催化氧化生成NO与水;
②NaH与水反应生成氢氧化钠与氢气,反应中只有NaH、水中的氢元素化合价变化,氧化产物与还原产物都是氢气,由氢元素化合价变化可知为1:1;
(4)过氧化钠首先与水反应生成氢氧化钠与氧气,氢氧化钠再与硫酸亚铁反应生成氢氧化亚铁沉淀,氢氧化亚铁在水被氧气氧化生成氢氧化铁,先写出各步反应,再利用质量守恒加合可得总反应式;
(5)工业合成氨采取“高温、高压和催化剂”条件;
根据氮气的三键结构、催化剂活性、反应速率与原料转化率分析选择条件.
解答:解:X由两种短周期元素组成的化合物,且为淡黄色固体,则X为Na2O2;Z遇空气变为红棕色,则Z为NO;W能使湿润的红色石蕊试纸变蓝色,则W为NH3;结合转化关系,可以推知丙为O2,甲为Na,乙为N2,丁为H2,钠是活泼金属,氢气是活泼非金属,二者可以化合生成离子化合物NaH,故Y为NaH.
(1)Na2O2属于离子化合物,钠离子与过氧根之间形成离子键,过氧根离子中氧原子之间形成非极性键;
实验室通常利用氯化铵与氢氧化钙在加热的条件下制备氨气,反应方程式为:2NH4Cl+Ca(OH)2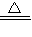 CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:离子键、非极性键;2NH4Cl+Ca(OH)2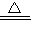 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)将钠投入氯化铁溶液中,钠首先与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铁反应生成氢氧化铁红褐色沉淀,故现象为:钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生,
故答案为:钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生;
(3)①氨气催化氧化生成NO与水,方程式为:4NH3+5O2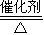 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2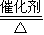 4NO+6H2O;
4NO+6H2O;
②NaH与水反应生成氢氧化钠与氢气,方程式为:NaH+H2O=NaOH+H2↑,反应中只有NaH、水中的氢元素化合价变化,氧化产物与还原产物都是氢气,由氢元素化合价变化可知为1:1,
故答案为:NaH+H2O=NaOH+H2↑;1:1;
(4)过氧化钠首先与水反应生成氢氧化钠与氧气,氢氧化钠再与硫酸亚铁反应生成氢氧化亚铁沉淀,氢氧化亚铁在水被氧气氧化生成氢氧化铁,发生反应:
①2Na2O2+2H2O═4NaOH+O2↑,
②FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,
③4Fe(OH)2+O2+2H2O=4Fe(OH)3,
①×2+②×4+③得4Na2O2+4FeSO4+2H2O=4Fe(OH)3+4Na2SO4+O2↑,
故离子方程式为4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑,
故答案为:4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑;
(5)工业合成氨采取“高温、高压和催化剂”条件,氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率,
故答案为:高温、高压和催化剂;氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率.
点评:本题考查了无机物推断、常用化学用语、化学工业等,题目综合性较强,(4)中离子方程式的书写为易错点、难点,注意根据各步反应利用质量守恒进行书写总的反应式,再书写离子方程式.
(1)Na2O2属于离子化合物,过氧根离子中氧原子之间形成非极性键;
实验室制备氨气通常利用氯化铵与氢氧化钙,在加热的条件下制备,反应生成氯化钙、氨气与水;
(2)将钠投入氯化铁溶液中,钠首先与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铁反应生成氢氧化铁红褐色沉淀;
(3)①氨气催化氧化生成NO与水;
②NaH与水反应生成氢氧化钠与氢气,反应中只有NaH、水中的氢元素化合价变化,氧化产物与还原产物都是氢气,由氢元素化合价变化可知为1:1;
(4)过氧化钠首先与水反应生成氢氧化钠与氧气,氢氧化钠再与硫酸亚铁反应生成氢氧化亚铁沉淀,氢氧化亚铁在水被氧气氧化生成氢氧化铁,先写出各步反应,再利用质量守恒加合可得总反应式;
(5)工业合成氨采取“高温、高压和催化剂”条件;
根据氮气的三键结构、催化剂活性、反应速率与原料转化率分析选择条件.
解答:解:X由两种短周期元素组成的化合物,且为淡黄色固体,则X为Na2O2;Z遇空气变为红棕色,则Z为NO;W能使湿润的红色石蕊试纸变蓝色,则W为NH3;结合转化关系,可以推知丙为O2,甲为Na,乙为N2,丁为H2,钠是活泼金属,氢气是活泼非金属,二者可以化合生成离子化合物NaH,故Y为NaH.
(1)Na2O2属于离子化合物,钠离子与过氧根之间形成离子键,过氧根离子中氧原子之间形成非极性键;
实验室通常利用氯化铵与氢氧化钙在加热的条件下制备氨气,反应方程式为:2NH4Cl+Ca(OH)2
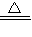 CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,故答案为:离子键、非极性键;2NH4Cl+Ca(OH)2
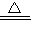 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;(2)将钠投入氯化铁溶液中,钠首先与水反应生成氢氧化钠与氢气,氢氧化钠再与氯化铁反应生成氢氧化铁红褐色沉淀,故现象为:钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生,
故答案为:钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生;
(3)①氨气催化氧化生成NO与水,方程式为:4NH3+5O2
 4NO+6H2O,
4NO+6H2O,故答案为:4NH3+5O2
 4NO+6H2O;
4NO+6H2O;②NaH与水反应生成氢氧化钠与氢气,方程式为:NaH+H2O=NaOH+H2↑,反应中只有NaH、水中的氢元素化合价变化,氧化产物与还原产物都是氢气,由氢元素化合价变化可知为1:1,
故答案为:NaH+H2O=NaOH+H2↑;1:1;
(4)过氧化钠首先与水反应生成氢氧化钠与氧气,氢氧化钠再与硫酸亚铁反应生成氢氧化亚铁沉淀,氢氧化亚铁在水被氧气氧化生成氢氧化铁,发生反应:
①2Na2O2+2H2O═4NaOH+O2↑,
②FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,
③4Fe(OH)2+O2+2H2O=4Fe(OH)3,
①×2+②×4+③得4Na2O2+4FeSO4+2H2O=4Fe(OH)3+4Na2SO4+O2↑,
故离子方程式为4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑,
故答案为:4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑;
(5)工业合成氨采取“高温、高压和催化剂”条件,氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率,
故答案为:高温、高压和催化剂;氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率.
点评:本题考查了无机物推断、常用化学用语、化学工业等,题目综合性较强,(4)中离子方程式的书写为易错点、难点,注意根据各步反应利用质量守恒进行书写总的反应式,再书写离子方程式.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
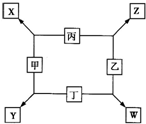
 甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )
甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是( )| A、若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3 | ||||
B、若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2
| ||||
| C、若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | ||||
| D、若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐 |
 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.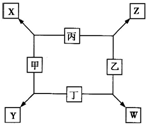 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.