题目内容
12.下列物质的熔、沸点高低顺序正确的是( )| A. | 金刚石>晶体硅>碳化硅 | B. | CF4>CCl4>CBr4>CI4 | ||
| C. | MgO>CaO>NaCl>CsCl | D. | K>Na>Li>Hg |
分析 A.原子晶体中,共价键的键长越小,熔沸点越大;
B.分子晶体中,相对分子质量越大,熔沸点越大;
C.离子晶体中,电荷越大,离子半径越小,熔沸点越大;
D.金属晶体中,离子半径越小,电荷越大,熔沸点越大.
解答 解:A.原子晶体中,共价键的键长越小,熔沸点越大,则熔沸点为金刚石>碳化硅>晶体硅,故A错误;
B.分子晶体中,相对分子质量越大,熔沸点越大,则熔沸点为CF4<CCl4<CBr4<CI4,故B错误;
C.离子晶体中,电荷越大,离子半径越小,熔沸点越大,则熔沸点为MgO>CaO>NaCl>CsCl,故C正确;
D.金属晶体中,离子半径越小,电荷越大,熔沸点越大,则熔沸点为Li>Na>K>Hg,故D错误;
故选C.
点评 本题考查晶体类型及性质,为高频考点,把握物质中的化学键、晶体类型及性质为解答的关键,侧重分析与应用能力的考查,注意性质比较方法,题目难度不大.

练习册系列答案
相关题目
20.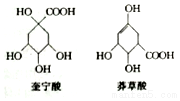 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| B. | 奎宁酸的相对分子质量比莽草酸的大16 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
7.下列反应中,浓硫酸既表现强氧化性,又表现酸性的是( )
| A. | 浓硫酸与氧化亚铁反应 | B. | 浓硫酸与木炭粉反应 | ||
| C. | 浓硫酸与氧化铜反应 | D. | 浓硫酸与氯化钠固体 |
17.关于某有机物 的性质叙述不正确的是( )
的性质叙述不正确的是( )
 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 1 mol该有机物完全燃烧可生成12molCO2 | |
| B. | lmol该有机物分别与足量Na或NaHCO3反应,产生的气体分子数目相等 | |
| C. | 1 mol该有机物可以与5mol H2发生加成反应 | |
| D. | 1 mol该有机物可以与2 molNaOH发生反应 |
4.下列各组物质的熔点均与所含化学键的强弱无关的是( )
| A. | CaO与CO2 | B. | NaCl与HCl | C. | CaF2与H2O | D. | Cl2与I2 |
2.下列关于胶体的叙述中,不正确的是( )
| A. | 利用丁达尔效应是区分胶体与溶液的一种常用物理方法 | |
| B. | 在煮沸的氢氧化钠溶液中滴加5~6滴饱和氯化铁溶液可制得氢氧化铁胶体 | |
| C. | 利用的胶体聚沉的性质在豆浆里加入盐卤做豆腐 | |
| D. | 胶体区别于其它分散系的本质特征是分散至粒子直径的大小 |


 有机物A是合成芬必得的主要原料,其结构简式如图与A具有相同的分子式,且苯环上只有一个取代基的有机物共有四种,除A外的其余三种分别是:
有机物A是合成芬必得的主要原料,其结构简式如图与A具有相同的分子式,且苯环上只有一个取代基的有机物共有四种,除A外的其余三种分别是: 、
、 、
、 .
.