题目内容
下列变化不能用勒夏特列原理解释的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.H2、I2、HI 混合气体加压后颜色变深
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案氮元素可形成多种化合物,在工业生产中具有重要价值。 请回答下列问题:
(1)已知拆开1molH-H 键,1molN-H键, 1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应合成NH3的热化学方程式为 ______________________。
(2)一定温度下,2L密闭容器中充入0.40 mol N2O4,发生反应:N2O4(g) 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
C(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①20 s内,v(NO2)=___________mol·L-1·s-1。
②升高温度时,气体颜色加深,则正反应是_________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数数值为_____________。
④相同温度下,若开始向该容器中充入0.80molNO2,则达到平衡后: c(NO2) ______ 0.30mol·L-1(填“>”、 “=”或“<”)
(3)N2O5是一种新型硝化剂,其性质和制备受人们关注。现以 H2、O2、熔融盐 Z(Na2CO3)组成的燃料电池电解制备N2O5,装置如图所示,其中Y为CO2。
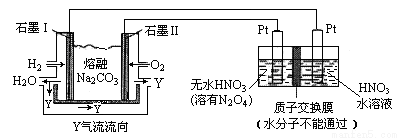
①写出石墨I电极上发生反应的电极反应式 _____________________________;
②在电解池中生成N2O5的电极反应式为 ____________________________
在一定温度下,将气体 X 和气体Y各0.16 mol 充入10 L恒容密闭容器中,发生反应X(g)+Y(g)  2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是 ( )
A.反应前2 min 的平均速率 v(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前 v(逆)>v(正)
C.该温度下此反应的平衡常数 K=1.44
D.其他条件不变,再充入 0.2 mol Z,平衡时X的体积分数增大


 知:2SO2(g)+O2(g)
知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ·mol-1
2SO3(g) ΔH=-196.6kJ·mol-1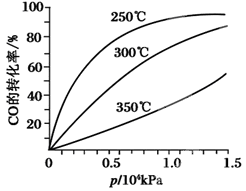 图乙:
图乙:

 D.K+、Mg2+、NO3-、Cl-
D.K+、Mg2+、NO3-、Cl-