题目内容
(6分)32 g铜与150 mL一定浓度的硝酸恰好完全反应,产生NO和NO2混合气体在标准状况下的体积为11.2 L。求
(1) NO、NO2的体积各为多少?
(2) 此硝酸的浓度为多少?
(1) NO、NO2的体积各为多少?
(2) 此硝酸的浓度为多少?
(1)NO2为5.6L NO为5.6 L (2)10 mol/L
(1)NO和NO2混合气的物质的量是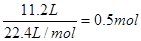 。32g铜是
。32g铜是
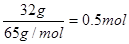 ,在反应中失去电子0.5mol×2=1.0mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.0mol,又因为n(NO)+n(NO2)=0.5mol,解得n(NO)=0.25mol,所以其体积是0.25mol×22.4L/mol=5.6L,则NO2的体积是11.2L-5.6L=5.6L。
,在反应中失去电子0.5mol×2=1.0mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.0mol,又因为n(NO)+n(NO2)=0.5mol,解得n(NO)=0.25mol,所以其体积是0.25mol×22.4L/mol=5.6L,则NO2的体积是11.2L-5.6L=5.6L。
(2)因为二者恰好反应,所以根据原子守恒可知溶液中硝酸铜的物质的量是0.5mol,则没有被还原的硝酸的物质的量是0.5mol×2=1.0mol,由被还原的硝酸是0.5mol,所以原硝酸的物质的量是1.0mol+0,5mol=1.5mol,因此其浓度是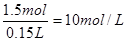 。
。
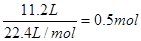 。32g铜是
。32g铜是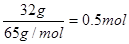 ,在反应中失去电子0.5mol×2=1.0mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.0mol,又因为n(NO)+n(NO2)=0.5mol,解得n(NO)=0.25mol,所以其体积是0.25mol×22.4L/mol=5.6L,则NO2的体积是11.2L-5.6L=5.6L。
,在反应中失去电子0.5mol×2=1.0mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.0mol,又因为n(NO)+n(NO2)=0.5mol,解得n(NO)=0.25mol,所以其体积是0.25mol×22.4L/mol=5.6L,则NO2的体积是11.2L-5.6L=5.6L。(2)因为二者恰好反应,所以根据原子守恒可知溶液中硝酸铜的物质的量是0.5mol,则没有被还原的硝酸的物质的量是0.5mol×2=1.0mol,由被还原的硝酸是0.5mol,所以原硝酸的物质的量是1.0mol+0,5mol=1.5mol,因此其浓度是
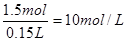 。
。
练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目