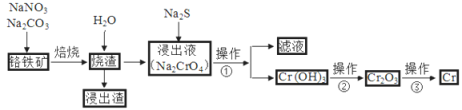
题目内容
【题目】某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
(1)该反应的化学方程式为_______________________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为________________;
(3)混合气体的平均相对分子质量比起始时___________;(填“大”,“小”或“相等”)
平衡时容器内混合气体密度比起始时______(填“大”,“小”或“相等”)
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________.
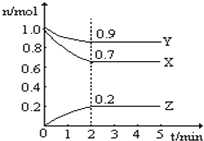
【答案】3X+Y2Z 0.01mol/(Lmin) 大 相等 7:5
【解析】
(1)化学方程式中,反应的物质系数之比等于各个物质的量的变化量之比;
(2)根据化反应速率v=![]() 来计算化学反应速率;
来计算化学反应速率;
(3)混合气体的平均相对分子质量M=![]() ,混合气体密度ρ=
,混合气体密度ρ=![]() 来判断;
来判断;
(4)根据化学反应中的三段式进行计算。
(1)根据图示的内容知道,X和Y是反应物,X、Y、Z的变化量之比是0.3:0.1:0.2=3:1:2,反应的化学方程式为:3X+Y2Z;
(2)反应开始至2min,以气体Z表示的平均反应速率v=![]() =0.01 mol/(Lmin);
=0.01 mol/(Lmin);
(3)混合气体的平均相对分子质量M=![]() ,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大;混合气体密度ρ=
,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大;混合气体密度ρ=![]() ,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,即相等;
,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变,即相等;
(4) 3X+Y2Z(设Y的变化量是x)
初始量:a b 0
变化量:3x x 2x
平衡量:a-3x b-x 2x
当n (X)=n (Y)=2n (Z)时,a-3x=b-x=4x,则a=7x,b=5x,所以原混合气体中a:b=7:5。