��Ŀ����
B��H2O��g����H2O��l���ų���������H2��g��+
| 1 |
| 2 |
C����B��֪Q2��241.8����C����
D����Ӧ�������������Ӱ�죬���������ͬ����Ӧ�Ȳ�ͬ����D����
��ѡB��

| H-H | O�TO | H-O | |
| ���ܣ�kJ/mol�� | 436.4 | a | 462.8 |
| A��185.2 | B��224.0 |
| C��518.8 | D��494 |
��14�֣�
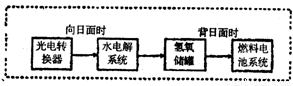
I���ҹ����������Լ������˿ռ�վ�����˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��
��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2CO2=2CO+O2��CO������ȼ�ϡ���֪�÷�Ӧ��ij����ӦΪ��4OH-��4e-=O2��+2H2O������һ����ӦΪ�� ��
������������������ij�¶��µķ�Ӧ��2CO=2C+O2����H>O����S<O��������CO����Ⱦ�������жϸ��¶���������Ӧ�Ƿ��ܷ�����˵�������� ��
��.�����̵�������Ȼ�̵����ϳɰ���Ŀǰ�˹��̵�����Ҫ��������ѧ��һֱ�������˹��̵����·������о���
���йش����̵�(��N2+O2  2NOΪ��)���˹��̵�(��N2+3H2
2NOΪ��)���˹��̵�(��N2+3H2  2NH3Ϊ��)��Ӧ��ƽ�ⳣ��
2NH3Ϊ��)��Ӧ��ƽ�ⳣ��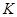 ��ֵ���±���
��ֵ���±���
|
��Ӧ |
N2+02
|
N2+3H2 |
||
|
�¶�/�� |
27 |
2000 |
100 |
400 |
|
K |
3.84��10-31 |
0.1 |
3.4��109 |
2.0x104 |
����˵����ȷ���� ��(����ĸ)
a�������̵����˹��̵����Ƿ��ȷ�Ӧ
b������ģ������̵�����ʵ����
c��Ѱ���ڳ����ºϳɰ��ĸ�Ч������Ŀǰ�˹��̵����·���
d���ڳ����£��˹��̵��dz�������
����֪��N2(g)+3H2(g) 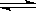 2NH3(g)
2NH3(g) 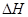 =-92.4kJ��mol-1
=-92.4kJ��mol-1
2H2(g)+02(g)=2H20(1)
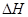 =-571.6 kJ��mol-1
=-571.6 kJ��mol-1
�ݱ������ڳ��¡���ѹ�����ա������������£�N2������ˮ��Ӧ����Ӧ N2(g)+3H20(1)=2NH3(g)+3��2O2(g)��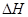 = KJ��mol-1��
= KJ��mol-1��
��ij�о�С����673 K��30 MPa�£������Ϊ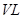 ���ܱ������н��з�Ӧ��N2(g)+3H2(g)
���ܱ������н��з�Ӧ��N2(g)+3H2(g) 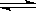 2NH3(g)����
(H2)�� (NH3)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
2NH3(g)����
(H2)�� (NH3)��ʱ��仯�Ĺ�ϵ��ͼ��ʾ��

������������ȷ���� ��(����ĸ)
A����a������Ӧ���ʱȵ�b�Ĵ�
B����c����Ӧ�ﵽ��ѧƽ��״̬
C����t3ʱ��673 K����773 K���� (H2)������
�ڴӿ�ʼ��ƽ��ʱ��Ӧ��ƽ������(��H2��Ũ�ȱ仯��ʾ) (H2)= ��
������ʼʱ (N2)= (H2)����Ӧ��ƽ�ⳣ��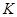 =
(�ô���ʽ��ʾ)��
=
(�ô���ʽ��ʾ)��
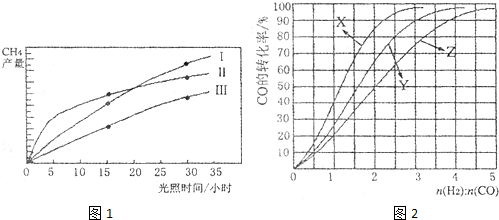
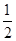 O2��g����CO��g����2H2��g�� ��H2=��35.4 kJ��mol-1
O2��g����CO��g����2H2��g�� ��H2=��35.4 kJ��mol-1 [Cu(NH3)3]Ac��CO ��H��0
[Cu(NH3)3]Ac��CO ��H��0