��Ŀ����
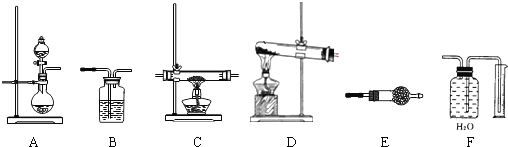
����Ŀ��ij��ѧʵ��С�飬ͨ��Li3N�����ˮ��Ӧ��ȡ�����������а�����ԭ����ͭ��ʵ��̽��������ͼ��ʾ�������˱�ʵ��ɹ�ѡ���װ�ã�
��ش��������⣺
��1�����÷����ư���ʱ��Ӧѡ������װ���е�______����װ�ô��룬��ͬ������������װ�á�д��Li3N��ˮ��Ӧ��ȡ�����Ļ�ѧ����ʽ____________________��
��2��Ϊ���鰱����ԭ����ͭ��Ӧ������Cu��H2O��N2����������װ�ú�Ӧ��������_____��C��____��_____����������װ�ÿ��ظ�ʹ�ã�
��3�������������CuO����ԭʱ������ɫ������ȫ��Ϊ��ʱ����һ����ȫת��ΪCu�����ܻ�����Cu2O����֪���ĵ�һ���ӷ�Ӧ����ʽ��Cu2O+2H+�TCu2++Cu+H2O�����ݸ���Ϣ����Ҫ֤��C���ĺ�ɫ�������Ƿ���Cu2O�������ʵ�飺_____________________________ ��
��4����ͬѧ��Ϊ��������ʵ����ƸĽ����װ�û��ɲⶨCu�����ԭ������������ͨ���ⶨ��Ӧ��CuO��������������H2O����������ɵġ���ʵ������ȫ��Ӧ��CuO�����ɵ�H2O�������ֱ�Ϊm��CuO����m��H2O������ݴ˼���Cu�����ԭ��Ϊ______��
���𰸡� A Li3N+3H2O=3LiOH+ NH3 EEF ȡ���������Թ��У�����ϡ������Һ������Һ��Ϊ��ɫ����֤����ɫ�����к���Cu2O ![]()
����������1��Li3N��ˮ��Ӧ����������﮺Ͱ���,����Ҫ����,ӦѡAΪ�����ķ���װ�ã���Ӧ�Ļ�ѧ����ʽ��Li3N+3H2O=3LiOH+NH3������ȷ�𰸣�A��Li3N+3H2O=3LiOH+NH3����
��2�����������Ҫ�������鰱����ԭ����ͭ��Ӧ������H2O,Ӧ���ȶԲ����İ������и���,��ѡ��Eװ��,Ȼ�����ʵ��,Ȼ��������װ��C�У�������Ӧ��ѡ��Eװ�ü���ˮ,�������ˮ���ռ�����������ȷ�IJ���˳��Ϊ:EEF����ȷ��:EEF��
��3��������Ϣ��֪��CuO�ܹ���ϡ���ᷴӦ��������ͭ��ɫ��Һ����ͭ��ϡ�����Ӧ�������ԭ����ͭ�к���Cu2O������Cu2O+2H+�TCu2++Cu+H2O��Ӧ��֪������ϡ�������Һ�б�Ϊ��ɫ������֤�����ۣ��������£�ȡ���������Թ��У�����ϡ������Һ������Һ��Ϊ��ɫ����֤����ɫ�����к���Cu2O����ȷ�𰸣�ȡ���������Թ��У�����ϡ������Һ������Һ��Ϊ��ɫ����֤����ɫ�����к���Cu2O��
��4����ͭ�����ԭ������Ϊx�����ݷ�Ӧ2NH3+3CuO=N2+3Cu+3H2O��֪��3��x+16��:3��18= m��CuO����m��H2O������֮��Cu�����ԭ��x=![]() ����ȷ����
����ȷ����![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�