题目内容
9.(1)100mL 98%的浓H2SO4,其密度为1.84g/cm3.该浓H2SO4的物质的量浓度为18.4mol/L,稀释至500mL后,其物质的量浓度为3.68mol/L.(2)同温同压下,同体积的H2和CO2物质的量之比为1:1,原子个数之比为2:3,质量比为1:22,同温同压下,同质量的H2和CO2分子个数之比为22:1,原子个数之比为44:3,体积比为22:1;若两者所含原子个数相等,它们的物质的量比是3:2.
分析 (1)根据物质的量浓度c=$\frac{1000ρω}{M}$计算出该浓硫酸的浓度;根据稀释过程中溶质的物质的量不变计算出稀释后的浓度;
(2)同温同压下,同体积的H2和CO2具有相同的物质的量、分子数;物质的量相等时质量之比与摩尔质量成正比;根据N=nNA=$\frac{m}{M}$NA可知,等质量的氢气和二氧化碳的分子数与摩尔质量成反比,根据分子数之比可计算出体积之比、原子个数之比;结合二者分子组成计算出两者所含原子个数相等时它们的物质的量比.
解答 解:(1)98%的浓硫酸溶液(ρ=1.84g/ml)的物质的量浓度为:c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L;
稀释后溶质的物质的量不变,则稀释500mL后溶液的浓度为:$\frac{18.4mol/L×0.1L}{0.5L}$=3.68mol/L,
故答案为:18.4 mol/L;3.68 mol/L;
(2)根据阿伏加德罗定律可知,同温同压下,同体积的H2和CO2物质的量相等,二者物质的量正比为1:1;原子个数之比为:(1×2):(1×3)=2:3;质量与摩尔质量成正比,则质量比为:2g/mol:44g/mol=1:22;同温同压下,同质量的H2和CO2分子个数之比与摩尔质量成反比,则二者分子数之比为:44g/mol:2g/mol=22:1;原子个数之比为:(22×2):(1×3)=44:3;相同条件下体积与物质的量成正比,则二者的体积比为22:1;若两者所含原子个数相等,二者的物质的量之比为:$\frac{1}{2}$:$\frac{1}{3}$=3:2,
故答案为:1:1;2:3;1:22;22:1;44:3;22:1;3:2.
点评 本题考查了阿伏加德罗定律及其讨论的应用,题目难度中等,明确物质的量与摩尔质量、阿伏伽德罗常数等知识的关系为解答关键,注意熟练掌握阿伏加德罗定律及其讨论的内容.

 名校课堂系列答案
名校课堂系列答案| A. | ${\;}_{6}^{14}C$、${\;}_{7}^{14}N$互为同位素 | |
| B. | NH3的电子式: | |
| C. | 质量数为133、中子数为78的铯原子:${\;}_{78}^{133}Cs$ | |
| D. | ${\;}_{8}^{18}{O}^{2-}$的结构示意图: |
| A. |  氯化钠 | B. |  乙醇 | C. |  木炭 | D. |  氢氧化钠 |
| A. | 0.60 mol/L | B. | 0.50 mol/L | C. | 0.45 mol/L | D. | 0.55 mol/L |
| A. | 离子化合物中不可能有非极性键 | |
| B. | 共价化合物分子里一定不含离子键 | |
| C. | 非极性键只存于双原子单质分子里 | |
| D. | 不同元素组成的多原子分子里的化学键一定都是极性键 |
| A. | “地沟油”禁止食用,但可用作制取肥皂的原料 | |
| B. | 因为铝单质不易被氧化,所以铝制用品有一定的抗腐蚀性 | |
| C. | 氮和硫的氧化物任意排放都会造成大气的污染 | |
| D. | 石油裂化、煤的气化、煤的液化的过程中都包含化学变化 |
| A. | 铜与浓硝酸 | B. | 铜与浓硫酸 | ||
| C. | 铜与稀硝酸 | D. | 二氧化锰与浓盐酸 |
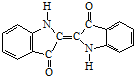
| A. | 它的化学式是C16H10N2O2 | B. | 它是高分子化合物 | ||
| C. | 它可以使溴水褪色 | D. | 它的苯环上的一氯取代产物有4种 |
| A. | 由于铝在空气中不会锈蚀,所以铝制品的使用寿命都很长 | |
| B. | 由于铝具有强还原性,所以常用铝来冶炼某些高熔点金属 | |
| C. | 常温下,铝遇浓硫酸钝化,所以可用浓硫酸除去铝表面的铜镀层 | |
| D. | 由于铝的导电性比铜强,所以常用铝制造电线、电缆 |