题目内容
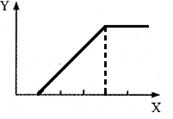
烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )


| A.曲线a表示Ba2+的物质的量的变化 |
| B.曲线c表示OH-的物质的量的变化 |
C.加入Ba(OH)2溶液50 mL反应的离子方程式为Ba2++OH-+H++SO42— BaSO4↓+H2O BaSO4↓+H2O |
D.加入Ba(OH)2溶液大于50 mL后,反应的离子方程式为OH-+H+ H2O H2O |
B
起始n(NaHSO4)="0.1" mol,即n(Na+)="0.1" mol[反应前后n(Na+)不变,所以曲线不对应Na+],n(H+)="0.1" mol,n(SO42—)="0.1" mol,加入Ba(OH)2溶液后,SO42—、H+要减少,加入Ba(OH)2溶液50 mL时,即n[Ba(OH)2]="0.05" mol,此时H+中和完,所以曲线b表示H+的变化,SO42—反应一半,当加入Ba(OH)2溶液大于50 mL时,OH-开始增多,所以曲线c表示OH-的变化,当加入Ba(OH)2溶液100 mL时,SO42—沉淀完,所以曲线a表示SO42—的变化,加入Ba(OH)2溶液大于100 mL时,Ba2+开始增多,所以曲线d表示Ba2+的变化,加入Ba(OH)2溶液50 mL 时,反应的H+与SO42—的物质的量之比为2∶1,所以离子方程式为:Ba2++2OH-+2H++SO42— 2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42—
2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42— BaSO4↓。
BaSO4↓。
 2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42—
2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42— BaSO4↓。
BaSO4↓。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
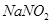 是一种食品添加剂,它与酸性
是一种食品添加剂,它与酸性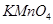 溶液的反应方程式为:
溶液的反应方程式为: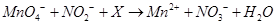 ,下列叙述中正确的是
,下列叙述中正确的是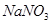 需消耗0.4mo1
需消耗0.4mo1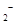 被还原
被还原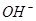
 Si+CO2
Si+CO2

 Cu2++2NO2↑+2H2O
Cu2++2NO2↑+2H2O +Ba2++3OH-
+Ba2++3OH- Fe(OH)3↓+BaSO4↓
Fe(OH)3↓+BaSO4↓ +HClO
+HClO
 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。