题目内容
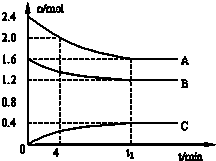
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )

A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B. t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
【答案】
BC
【解析】根据图1可知,反应的方程式是3A+B 2C,所以增大压强,平衡向正反应方向进行,A不正确;保持容器总压强不变,通入稀有气体,则物质的浓度必然是减小的,所以平衡向逆反应方向减小,B正确;根据图像可知,平衡时ABC的浓度(mol/L)分别是0.3、0.1、0.4,所以选项C正确;根据图像2可知,T1曲线首先平衡,所以TI大于T2。温度高B的转化率降低,即正反应是放热反应,所以选项D不正确,答案选BC。
2C,所以增大压强,平衡向正反应方向进行,A不正确;保持容器总压强不变,通入稀有气体,则物质的浓度必然是减小的,所以平衡向逆反应方向减小,B正确;根据图像可知,平衡时ABC的浓度(mol/L)分别是0.3、0.1、0.4,所以选项C正确;根据图像2可知,T1曲线首先平衡,所以TI大于T2。温度高B的转化率降低,即正反应是放热反应,所以选项D不正确,答案选BC。

练习册系列答案
相关题目
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示. C
C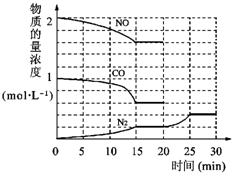 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: