题目内容
10.甲醇合成反应及其能量变化如图1所示:(1)写出合成甲醇的热化学方程式:CO(g)+2H2(g)═CH3OH(g)△H=-(b-a)kJ?mol-1.
(2)实验室在1L的密闭容器中进行模拟上述甲醇合成实验.将1mol CO和2mol H2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
时间 浓度(mol?L-1) 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
②在300℃反应开始10min内,H2的平均反应速率为υ(H2)=0.08 mol?L-1?min-1.
③在500℃达到平衡时,平衡常数K=25.
④在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2,在一定条件下达到平衡,测得容器中压
强为起始压强的一半,该条件下H2的转化率为80%.
(3)乙醇燃料电池具有很高的实用价值.图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+.
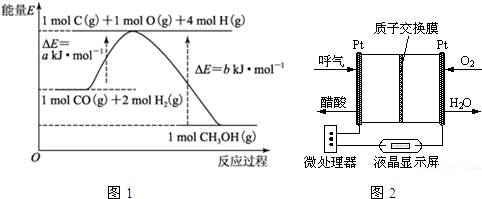
分析 (1)由图可知,1molO(g)、2molH2(g)合成1molCH3OH(g)放出热量为(b-a)kJ;
(2)①加入催化剂、升高温度、增大压强、增大物质浓度等均可以增大反应速率;
②根据v=$\frac{△c}{△t}$计算υ(CH3OH),再利用速率之比等于化学计量数之比计算υ(H2);
③在500℃时,40min达到平衡,计算平衡时各组分浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
④恒温恒容下,利用压强之比等于物质的量之比计算平衡时混合气体总物质的量,再利用差量法计算参加反应氢气物质的量,进而计算H2的转化率;
(3)负极发生氧化反应,由示意图可知,乙醇在负极失去电子得到乙酸,由元素守恒应有水参与反应,由电荷守恒应生成氢离子,氢离子通过质子交换膜,与正极的氧离子结合生成水.
解答 解:(1)由图可知,1molO(g)、2molH2(g)合成1molCH3OH(g)放出热量为(b-a)kJ,热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-(b-a)kJ?mol-1,
故答案为:CO(g)+2H2(g)═CH3OH(g)△H=-(b-a)kJ?mol-1;
(2)①a.随时将CH3OH与反应混合物分离,生成物浓度减小,反应速率减慢,故a错误;
b.降低反应温度,反应速率减慢,故b错误;
c.反应各组分均为气体,增大体系压强,反应速率加快,故c正确;
d.使用高效催化剂,降低活化能,反应速率加快,故d正确,
故选:cd;
②在300℃反应开始10min内,υ(CH3OH)=$\frac{0.4mol/L}{10min}$=0.04 mol?L-1?min-1,速率之比等于化学计量数之比,则υ(H2)=2υ(CH3OH)=0.08 mol?L-1?min-1,
故答案为:0.08 mol?L-1?min-1;
③在500℃时,40min达到平衡,平衡时甲醇浓度为0.8mol/L,则:
CO (g)+2H2(g)?CH3OH (g)
起始量(mol/L):1 2 0
转化量(mol/L):0.8 1.6 0.8
平衡量(mol/L):0.2 0.4 0.8
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×0.{4}^{2}}$=25,
故答案为:25;
④恒温恒容下,压强之比等于物质的量之比,故平衡时混合气体总物质的量为(1.2mol+2mol)×$\frac{1}{2}$=1.6mol,
CO(g)+2H2(g)═CH3OH(g)△n
2 2
n(H2) 3.2mol-1.6mol=1.6mol
故n(H2)=1.6mol,则H2的转化率为$\frac{1.6mol}{2mol}$×100%=80%,
故答案为:80%;
(3)负极发生氧化反应,由示意图可知,乙醇在负极失去电子得到乙酸,由元素守恒应有水参与反应,由电荷守恒应生成氢离子,氢离子通过质子交换膜,与正极的氧离子结合生成水,负极电极反应为:CH3CH2OH+H2O-4e-=CH3COOH+4H+,
故答案为:CH3CH2OH+H2O-4e-=CH3COOH+4H+.
点评 本题比较综合,涉及化学平衡计算、反应速率影响因素、热化学方程式书写、原电池等,(3)中注意根据原电池示意图判断发生的反应,难度中等.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案| A. | 1molNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为1mol•L-1 | |
| B. | 常温常压下,11.2L H2所含的原子数目小于NA | |
| C. | 0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 在钠与氯气的反应中,1mol钠失去电子的数目为2NA个 |
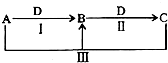 A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )
A、B、C、D是中学化学中常见物质,在一定条件下四者相互转化关系如图所示(部分反应中的水已略去),其中A、B、C均含有同一种元素.下列说法错误的是( )| A. | 若A为碳单质,则B可以用来灭火 | |
| B. | 若A为AlCl3,D为NaOH,则反应Ⅲ发生的是盐类双水解 | |
| C. | 若A为烧碱,D为CO2,则C的水溶液呈碱性 | |
| D. | 若A为氯水,D为日常生活中用途最广的金属单质,则I、Ⅱ、Ⅲ均是氧化还原反应 |
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol可知,若将1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 由C(石墨)═C(金刚石))△H=+1.90/mol可知,金刚石比石墨稳定 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |

 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题 和田玉因产于新疆和田而得名,以透闪石玉中的精品扬名于天下.透闪石玉又叫软
和田玉因产于新疆和田而得名,以透闪石玉中的精品扬名于天下.透闪石玉又叫软