题目内容
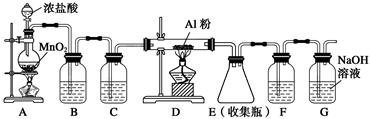
如图所示,A处通入氯气,关闭旋塞B时,C处红色布条无明显的变化,打开旋塞B时,C处红色布条逐渐褪色。由此作出的判断正确的是

| A.D中不可能是浓硫酸 | B.D中可以是水 |
| C.通入的氯气中含有水蒸气 | D.D中可以是饱和食盐水 |
C
试题分析:潮湿的氯气具有漂白性,干燥的氯气不具备漂白性。根据题意知,A处通入氯气,关闭旋塞B时,C处红色布条无变化,打开旋塞B时,C处红色布条褪色,说明通入的氯气中含有水蒸气,氯气和水反应生成次氯酸起漂白作用,遇到有色布条使其褪色;A、D中可能是浓硫酸,吸收氯气中的水蒸气,干燥的氯气不能漂白有色布条,所以C处红色布条无变化,错误;B、D中为水时,氯气通过后会含有水蒸气,会使有色布条褪色,错误;C、A处通入氯气,关闭旋塞B时,C处红色布条无变化,打开旋塞B时,C处红色布条褪色,说明通入的氯气中含有水蒸气,正确;D、D中是饱和食盐水时,氯气通过后会含有水蒸气,会使有色布条褪色,错误。

练习册系列答案
相关题目