题目内容
W、X、Y、Z是中学化学中四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,Z能形成红色(或砖红色)Z2O 和黑色的ZO两种氧化物.
(1)写出相关化学式:W
(2)W位于元素周期表第
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(4)已知下列数据:Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-12X(s)+
O2(g)=X2Os(s)△H=-1675.7kJ?mol-1X的单质和FeO反应的热化学方程式是
(1)写出相关化学式:W
N
N
,XAl
Al
,YS
S
,ZCu
Cu
(2)W位于元素周期表第
二
二
周期第VA
VA
族.W的气态氢化物稳定性比H2O(g)弱
弱
(填“强”或“弱”)(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O
| ||
2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O
.
| ||
(4)已知下列数据:Fe(s)+
| 1 |
| 2 |
| 3 |
| 2 |
2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol
2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol
.分析:W、Y的氧化物是导致酸雨的主要物质,常见物质为SO2、NO、NO2等,根据原子序数Y大于W,则W为N元素,Y为S元素,Z能形成红色(或砖红色)Z2O 和黑色的ZO两种氧化物,应为Cu2O和CuO两种氧化物,则Z为Cu,由题中(4)X的单质和FeO反应,可知X应为Al,结合元素对应的单质化合物的性质解答该题.
解答:解:(1)W、Y的氧化物是导致酸雨的主要物质,常见物质为SO2、NO、NO2等,根据原子序数Y大于W,则W为N元素,Y为S元素,Z能形成红色(或砖红色)Z2O 和黑色的ZO两种氧化物,应为Cu2O和CuO两种氧化物,则Z为Cu,由题中(4)X的单质和FeO反应,可知X应为Al,故答案为:N;Al;S;Cu;
(2)N的原子序数为7,原子核外有2个电子层,最外层电子数为5,应位于周期表第二周期ⅤA族,由于非金属性;N<O,则
NH3的稳定性比H2O弱,故答案为:二;VA;弱;
(3)Y的最高价氧化物对应水化物的浓溶液为浓硫酸,具有强氧化性,与Cu在加热条件下反应生成硫酸铜和二氧化硫和水,反应的化学方程式为2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O,
故答案为:2H2SO4(浓)+Cu
CuSO4+SO2↑+2H2O;
(4)X的单质和FeO反应,应为Al,则有:
①Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-1,
②2Al(s)+
O2(g)=Al2Os(s)△H=-1675.7kJ?mol-1,
利用盖斯定律将②-①×3可得:2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol,
故答案为:2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol;
(2)N的原子序数为7,原子核外有2个电子层,最外层电子数为5,应位于周期表第二周期ⅤA族,由于非金属性;N<O,则
NH3的稳定性比H2O弱,故答案为:二;VA;弱;
(3)Y的最高价氧化物对应水化物的浓溶液为浓硫酸,具有强氧化性,与Cu在加热条件下反应生成硫酸铜和二氧化硫和水,反应的化学方程式为2H2SO4(浓)+Cu
| ||
故答案为:2H2SO4(浓)+Cu
| ||
(4)X的单质和FeO反应,应为Al,则有:
①Fe(s)+
| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
利用盖斯定律将②-①×3可得:2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol,
故答案为:2Al(s)+3FeO(s)=3Fe(s)+Al2O3(s)△H=-859.7kJ/mol;
点评:本题考查元素周期律和周期表以及原子核外电子排布式,热化学方程式的书写,题目难度中等,本题注意Al的推断,题目中没有直接告诉,根据铁的冶炼,常用碳或铝做还原剂,题中C的原子序数小于N,应为Al.

练习册系列答案
相关题目
 W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题:
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高.试回答下列各题: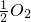 (g)=FeO(s)△H=-272.0kJ?mol-12X(s)+
(g)=FeO(s)△H=-272.0kJ?mol-12X(s)+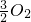 (g)=X2Os(s)△H=-1675.7kJ?mol-1X的单质和FeO反应的热化学方程式是______.
(g)=X2Os(s)△H=-1675.7kJ?mol-1X的单质和FeO反应的热化学方程式是______.