题目内容
已知氨与氧化铜反应可制备氮气(2NH3+3CuO=3Cu+3H2O+N2),纯N2与Mg在高温下反应可制得氮化镁,但氮化镁与水反应生成氢氧化镁和氨气.(1)下面是某化学课外小组的同学提出的实验室制备氨气的几种方案,其中可行的是( )
A.硫酸铵固体和消石灰共热 B.浓氨水逐滴加到新制的生石灰中
C.在一定条件下N2与H2化合 D.加热分解氯化铵固体
(2)该小组同学设计的制备氮化镁的方案有以下两个.分别见实验方案的装置图1和图2(夹持及加热仪器没有画出.且在实验前系统内的空气均已排除)
〔方案一〕
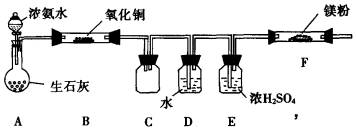
图1
①该实验完成后,能否得到纯净的氮化镁________(填“能”或“不能”);简述理由________________________.
②装置C的作用是________.
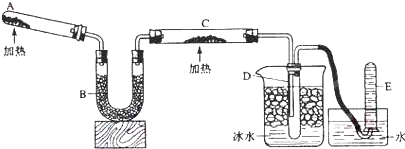
〔方案二〕

图2
已知:6NH3+3Mg=3Mg(NH2)2+3H2↑
③该方案中存在的主要问题是________________________.
④如何才能解决上述问题________________________.
答案:
解析:
解析:
| (1)AB (2)①不能.F管直接与空气相通,空气中水蒸气可进入F装置中与Mg3N2反应生成Mg(OH)2和NH3. ②防倒吸,作安全瓶③未与CuO反应的NH3进入E中与Mg反应. ④将D改为盛浓H2SO4的洗气瓶.
|

练习册系列答案
相关题目



 3Cu+3H2O+N2↑
3Cu+3H2O+N2↑

 3Mg(NH2)2+3H2↑
3Mg(NH2)2+3H2↑