题目内容
【题目】现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
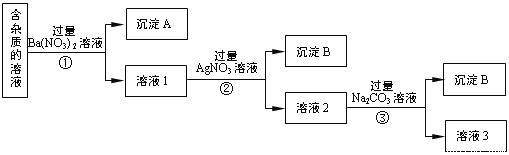
(1)沉淀A的主要成分是_____________、______________(填化学式)。
(2)①②③中均进行的分离操作是_______________。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________,为了除去杂质,可向溶液3中加入适量的______________。
(4)实验探究小组在实验中需要用到456 mL1 molL-1的HNO3溶液,但是在实验室中只发现一瓶8 molL-1的HNO3溶液,该小组用8molL-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括_________、________mL量筒、烧杯、__________、胶头滴管等。
②该实验中需要量取8molL-1的HNO3溶液________mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________。
A.取8molL-1的HNO3溶液溶液时仰视刻度线
B.量取用的量筒水洗后未进行任何操作
C. 8molL-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
(5)某同学转移溶液的操作如图所示,该同学操作中的错误是______________________________________。容量瓶的刻度线标在比较细的瓶颈之上的原因是___________。
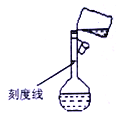
A.为了美观 B.为了统一标准 C.为了提高准确度 D.方便刻画
【答案】BaSO4BaCO3过滤Na2CO3HNO3500mL 容量瓶100玻璃棒62.5AC未用玻璃棒引流C
【解析】
由实验流程可知,加入过量的Ba(NO3)2,生成BaSO4、BaCO3沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3;
(1)加入过量的Ba(NO3)2,Na2SO4、Na2CO3和Ba(NO3)2反应生成BaSO4、BaCO3沉淀;
(2)①②③中均进行的分离操作用于分离固体和液体,为过滤操作;
(3)溶液3为NaNO3和Na2CO3的混合物,加入稀HNO3,可除去Na2CO3,最后加热蒸发、冷却结晶、过滤得到硝酸钠;
(4)①实验室只有500mL的容量瓶,则本实验需要配制的溶液体积为500mL,另外需要用量筒量8 molL-1的HNO3溶液倒在烧杯中加水溶解,同时需要玻璃棒搅拌,转移到容量瓶中时也需要玻璃棒引流,最后还需要用胶头滴管定容,整个实验需要的玻璃仪器包括500mL 容量瓶、100 mL量筒、烧杯、 玻璃棒、胶头滴管等;
②设需要量取8 molL-1的HNO3溶液VmL,则8 molL-1×V×10-3L=1 molL-1×500×10-3L,解得:V=62.5;
③A.取8molL-1的HNO3溶液溶液时仰视刻度线,液面在刻度线上方,即浓硝酸的体积偏大,导致配制溶液浓度偏高,故A正确;B.量取用的量筒水洗后未进行任何操作,会稀释浓硝酸,即浓硝酸的体积偏小,导致配制溶液浓度偏低,故B错误;C.量筒量取浓硝酸后,不应该水洗,否则浓硝酸的体积偏大,导致配制溶液浓度偏高,故C正确;D.定容时仰视刻度线,液面在刻度线上方,溶液体积偏大,导致浓度偏低,故D错误;E.定容后,除容量瓶振荡摇匀,不能再加水定容,这样做对实验结果无影响,故E错误;答案为AC。
(5)转移溶液的操作如图所示,错误操作是未用玻璃棒引流;容量瓶的刻度线标在比较细的瓶颈之上这样做的目的是为了提高准确度,与美观、方便刻画等没有关系,故答案为C。