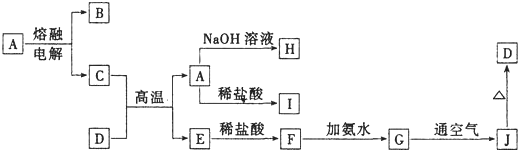
题目内容
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
C+ KMnO4+ H2SO4→ CO2↑+ MnSO4+ K2SO4+ H2O
(2)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式为 .
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1= .
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) .
a.T1>T2 b.T1<T2 c.无法比较
(4)CO2经常用氢氧化钠来吸收,现有0.4mol CO2,若用200ml 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下工作的燃料电池,其负极反应式:2CO+2CO32-=4CO2+4e-则正极反应式: ,电池总反应式 .
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(2)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式为
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 | 活性炭 | NO | E | F |
| n/mol | ||||
| T/℃ | ||||
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
Ⅰ.计算K1=
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)
a.T1>T2 b.T1<T2 c.无法比较
(4)CO2经常用氢氧化钠来吸收,现有0.4mol CO2,若用200ml 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下工作的燃料电池,其负极反应式:2CO+2CO32-=4CO2+4e-则正极反应式:
考点:化学平衡的计算,氧化还原反应,热化学方程式,化学电源新型电池
专题:基本概念与基本理论
分析:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,结合化合价升降总数相等以及质量守恒定律配平;
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此结合热化学方程式书写原则进行书写;
(3)由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
(4)据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来计算回答,根据溶液中离子浓度大小比较的方法结合电离和水解平衡来分析;
(5)通入氧气和CO2的混合气体一极为原电池的正极也称之为阴极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-.
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此结合热化学方程式书写原则进行书写;
(3)由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
(4)据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来计算回答,根据溶液中离子浓度大小比较的方法结合电离和水解平衡来分析;
(5)通入氧气和CO2的混合气体一极为原电池的正极也称之为阴极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-.
解答:
解:(1)反应中C元素的化合价由0升高为+4价,Mn元素的化合价由+7价降低为+2价,该反应中转移20e-,由电子守恒和质量守恒定律可知得化学反应为5C+4KMnO4+6HSO4=5CO2↑+4MnSO4+2K2SO4+6H2O,
故答案为:5;4;6;5;4;2;6;
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1;
(2)由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为C+2NO?N2+CO2,
Ⅰ、平衡时c(NO)=0.02mol/L,c(N2)=c(CO2)=0.015mol/L,故T1℃时该反应的平衡常数为K1=
=0.5625,
故答案为:0.5625;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(4)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,在混合物中,碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)正极上的电极反应式为O2+4e-+2CO2=2CO32-,负极反应式:2CO+2CO32-=4CO2+4e-,两式相加得电池反应为2CO+O2=2CO2,故答案为:O2+4e-+2CO2=2CO32-;
2CO+O2=2CO2.
故答案为:5;4;6;5;4;2;6;
(2)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ?mol-1;
(2)由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为C+2NO?N2+CO2,
Ⅰ、平衡时c(NO)=0.02mol/L,c(N2)=c(CO2)=0.015mol/L,故T1℃时该反应的平衡常数为K1=
| 0.015×0.015 |
| 0.022 |
故答案为:0.5625;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(4)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:2反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,在混合物中,碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(5)正极上的电极反应式为O2+4e-+2CO2=2CO32-,负极反应式:2CO+2CO32-=4CO2+4e-,两式相加得电池反应为2CO+O2=2CO2,故答案为:O2+4e-+2CO2=2CO32-;
2CO+O2=2CO2.
点评:本题考查平衡常数、化学平衡的有关计算、热化学方程式的书写、氧化还原方程式的书写、离子浓度大小比较等方面的知识,注重高频考点的考查,综合性强,题目难度大.

练习册系列答案
相关题目
 如图为元素周期表中短周期的一部分,其中b原子的最外层电子数为电子层数的两倍,则下列叙述中正确的是( )
如图为元素周期表中短周期的一部分,其中b原子的最外层电子数为电子层数的两倍,则下列叙述中正确的是( )| A、b的元素符号为C |
| B、a元素的最高正化合价为+6 |
| C、c元素的最高正化合价为+5 |
| D、b元素的气态氢化物的化学式为H2S |
已知:①CH3OH(g)+H2O(g)═CO2(g)+3H2(g),△H=+49.0kJ?mol-1;②CH3OH(g)+
O2(g)=CO2(g)+2H2(g),△H=-192.9kJ?mol-1.下列说法正确的是( )
| 1 |
| 2 |
A、根据②推知反应:CH3OH(l)+
| ||
| B、①反应中,反应物的总能量高于生成物总能量 | ||
| C、CH3OH转变成H2的过程一定要吸收能量 | ||
D、反应②中的能量变化如图所示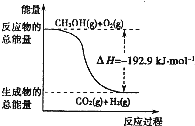 |
如表为元素周期表前四周期的一部分,下列有关X、W、Y、R、Z五种元素的叙述中,正确的是( )
| X | |||
| W | Y | R | |
| Z | |||
| A、常温常压下,五种元素对应的单质中有两种是气态 |
| B、Y元素最高价氧化物对应水化物的酸性比W元素的弱 |
| C、Y、Z的阴离子电子层结构都与R原子的相同 |
| D、W的氢化物比X的氢化物稳定 |