题目内容
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是 ( )

A. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 温度T下,该反应的平衡常数
【答案】D
【解析】A、先达到平衡,说明反应速率快,即b的温度比a高,根据图像,温度越高,N2的浓度越低,说明平衡向正反应方向进行,即△H>0,故A错误;B、组分都是气体,则气体质量保持不变,容器是恒容状态,气体体积不变,依据密度定义,密度始终保持不变,因此随着反应的进行,混合气体的密度不变,故B错误;C、催化剂对化学平衡移动无影响,因此b不可能使用了催化剂,故C错误;D、 N2(g)+O2(g)![]() 2NO(g)
2NO(g)
起始浓度:c0 c0 0
变化浓度:(c0-c1) (c0-c1) 2(c0-c1)
平衡浓度:c1 c1 2 (c0-c1) 根据化学平衡常数的定义,K= 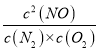 =
= ,故D正确。
,故D正确。

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目