题目内容
(12分)下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I、属于非电解质的是 (填序号)Ⅱ、⑴NaHCO3是一种 (填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式: ;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为: 。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴溶液中由水电离出c(OH―)=______________;
⑵与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
I、属于非电解质的是 (填序号)Ⅱ、⑴NaHCO3是一种 (填“强”或“弱”)电解质;
⑵写出HCO3―水解的离子方程式: ;
⑶常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、H2CO3、CO32―、OH―五种微粒的浓度由大到小的顺序为: 。
⑷常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= 。(已知:10-5.60=2.5×10-6)Ⅲ 、Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液。
⑴溶液中由水电离出c(OH―)=______________;
⑵与某浓度盐酸溶液按体积比(碱与酸之比)1: 9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=____________。
(12分) I、②(1分)
Ⅱ、⑴强(1分) ⑵HCO3― + H2O H2CO3 + OH―
H2CO3 + OH―
⑶c(Na+)>c(HCO3―)>c(OH―)>c(H2CO3)>c(CO32―) ⑷ 4.17×10-7(mol·L-1)
Ⅲ ⑴ 10-13mol·L-1 ⑵ 2 (除注明外每空2分)
Ⅱ、⑴强(1分) ⑵HCO3― + H2O
 H2CO3 + OH―
H2CO3 + OH―⑶c(Na+)>c(HCO3―)>c(OH―)>c(H2CO3)>c(CO32―) ⑷ 4.17×10-7(mol·L-1)
Ⅲ ⑴ 10-13mol·L-1 ⑵ 2 (除注明外每空2分)
试题分析: I、溶于水和在熔融状态下均不能导电的化合物是非电解质,所以属于非电解质的是SO2,答案选②。
Ⅱ、(1)溶于水完全电离的电解质,不存在电离平衡的是强电解质,因此碳酸氢钠是强电解质。
(2)碳酸氢钠水解的离子方程式是HCO3― + H2O
 H2CO3 + OH―。
H2CO3 + OH―。(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,说明HCO3―的水解程度大于电离程度,属于溶液中离子浓度大小顺序是c(Na+)>c(HCO3―)>c(OH―)>c(H2CO3)>c(CO32―)。
(4)溶液的pH=5.60,所以溶液中氢离子浓度是2.5×10-6mol/L,则根据电离方程式可知,c(HCO3―)=2.5×10-6mol/L,所以电离常数K1=
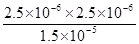 = 4.17×10-7(mol·L-1)。
= 4.17×10-7(mol·L-1)。Ⅲ、(1)氢氧化钡是强碱,抑制水的电离,所以25℃、pH=13的Ba(OH)2溶液中由水电离出c(OH―)=1× 10-13mol·L-1。
(2)所得溶液pH=11,说明碱是过量的,所以有
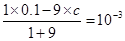 ,解得x=0.01mol/L,所以pH=2。
,解得x=0.01mol/L,所以pH=2。点评:该题知识面广,对学生的要求高,难度较大。重点考查学生对知识的熟练程度,以及运用知识解决实际问题的能力。

练习册系列答案
相关题目
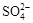 、K+
、K+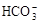 、Na+
、Na+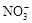 、ClO-、K+
、ClO-、K+