题目内容
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)实验②中所发生反应的离子方程式为_____________________________。
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为__________。
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是_____________________________。
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)实验②中所发生反应的离子方程式为_____________________________。
(3)甲溶液的物质的量浓度为 ,乙溶液的物质的量浓度为__________。
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是_____________________________。
(1)HCl Na2CO3
(2)CO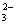 +H+ ="===" HCO
+H+ ="===" HCO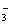 HCO
HCO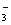 +H+ ="===" CO2↑+H2O
+H+ ="===" CO2↑+H2O
(3)0.8 mol·L-1 1 mol·L-1
(4)0≤V≤8.96n
(2)CO
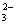 +H+ ="===" HCO
+H+ ="===" HCO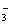 HCO
HCO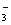 +H+ ="===" CO2↑+H2O
+H+ ="===" CO2↑+H2O (3)0.8 mol·L-1 1 mol·L-1
(4)0≤V≤8.96n
(1)当向盐酸中加入Na2CO3溶液时,发生反应2H++CO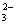 ="===" CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO
="===" CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO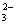 +H+ ="===" HCO
+H+ ="===" HCO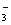 ,当所有CO
,当所有CO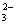 均转化为HCO
均转化为HCO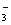 时,再发生反应HCO
时,再发生反应HCO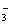 +H+ ="===" CO2↑+H2O。由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为HCl、乙为Na2CO3。
+H+ ="===" CO2↑+H2O。由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为HCl、乙为Na2CO3。
(3)设盐酸的物质的量浓度为c(HCl),Na2CO3溶液的物质的量浓度为c(Na2CO3),由实验①得:25.00×10 –3 L·c(HCl) · =
=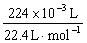 ,c(HCl)="0.8" mol·L-1;
,c(HCl)="0.8" mol·L-1;
由实验②得: 15.00×10-3 L·c(Na2CO3)=25.00×10-3 L×0.8 mol·L-1-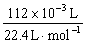 ,
,
c(Na2CO3)="1" mol·L-1。
(4)等体积的甲、乙按实验①的方式进行时产生气体的体积为:
 ×n×10-3 L×0.8 mol·L-1×22.4 l·mol-1 =8.96×10-3 nL,若按实验②的方式进行,由反应CO
×n×10-3 L×0.8 mol·L-1×22.4 l·mol-1 =8.96×10-3 nL,若按实验②的方式进行,由反应CO +H+ ="===" HCO-3可知盐酸不足,不产生气体,故0≤V≤8.96 n。
+H+ ="===" HCO-3可知盐酸不足,不产生气体,故0≤V≤8.96 n。
 ="===" CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO
="===" CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO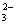 +H+ ="===" HCO
+H+ ="===" HCO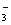 ,当所有CO
,当所有CO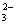 均转化为HCO
均转化为HCO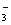 时,再发生反应HCO
时,再发生反应HCO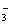 +H+ ="===" CO2↑+H2O。由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为HCl、乙为Na2CO3。
+H+ ="===" CO2↑+H2O。由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为HCl、乙为Na2CO3。(3)设盐酸的物质的量浓度为c(HCl),Na2CO3溶液的物质的量浓度为c(Na2CO3),由实验①得:25.00×10 –3 L·c(HCl) ·
 =
=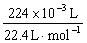 ,c(HCl)="0.8" mol·L-1;
,c(HCl)="0.8" mol·L-1;由实验②得: 15.00×10-3 L·c(Na2CO3)=25.00×10-3 L×0.8 mol·L-1-
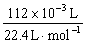 ,
,c(Na2CO3)="1" mol·L-1。
(4)等体积的甲、乙按实验①的方式进行时产生气体的体积为:
 ×n×10-3 L×0.8 mol·L-1×22.4 l·mol-1 =8.96×10-3 nL,若按实验②的方式进行,由反应CO
×n×10-3 L×0.8 mol·L-1×22.4 l·mol-1 =8.96×10-3 nL,若按实验②的方式进行,由反应CO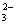 +H+ ="===" HCO-3可知盐酸不足,不产生气体,故0≤V≤8.96 n。
+H+ ="===" HCO-3可知盐酸不足,不产生气体,故0≤V≤8.96 n。
练习册系列答案
相关题目
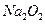 ,放出
,放出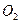 ,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。