题目内容
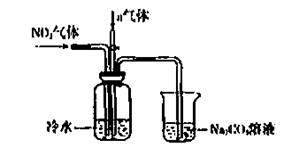
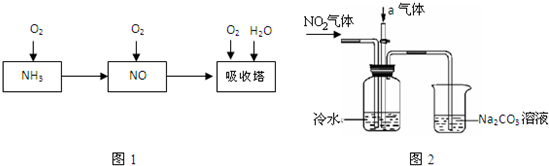
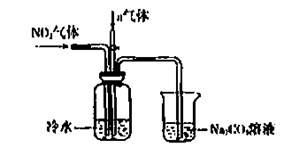
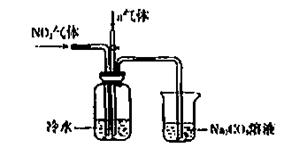
某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)
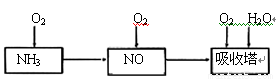
(1)工业上用氨气制取NO的化学方程式是 。
(2)连接好装置后,首先进行的操作是 。
(3)通入a气体的目的是 .
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是
2NO2+Na2CO3=====NaNO2+ +
(5)已知:温度低于21.15°C时,NO2几乎全部转变为N2O2。工业上可用N2O4与水反应来提高硝酸产率。N2O4与a气体在冷水中生成硝酸的化学方程式是 。
 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为
。
【答案】
(1)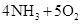
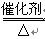 4NO+6H2O
4NO+6H2O
(2)检验装置的气密性
(3)提高NO2的转化率(或2NO+O2=2NO2)(合理均给分)
(4)NaNO3 CO2
(5)2N2O4+O2+2H2O=4HNO3
(6)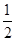 50%
50%
【解析】

练习册系列答案
相关题目
 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。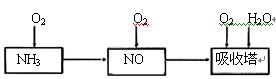
 (6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K= 。若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。