题目内容
设NA表示阿伏加德罗常数,下列说法正确的是
① 6.8g熔融的KHSO4中含有0.1Na个阳离子。
② 1L1mol/L的盐酸溶液中,含HCl分子数为1Na。
③ 常温常压下,11.2L的CH4中含有的H数为2Na。
④ 0.1molNa2O2与水完全反应,转移0.2NA的电子。
⑤ 62gNa2O溶于水中,所得溶液中有1Na个O2-
⑥ 1L1mol/L的醋酸溶液中离子总数为2Na
⑦ 标准状况下,22.4L氩气含有原子数为2Na。
⑧ 常温常压下,32gO2、O3的混合物含有2Na个氧原子。
⑨ 1L1mol/L的酒精溶液,含有1Na个分子。
⑩1molFe和足量的盐酸反应,失去3Na个电子。
① 6.8g熔融的KHSO4中含有0.1Na个阳离子。
② 1L1mol/L的盐酸溶液中,含HCl分子数为1Na。
③ 常温常压下,11.2L的CH4中含有的H数为2Na。
④ 0.1molNa2O2与水完全反应,转移0.2NA的电子。
⑤ 62gNa2O溶于水中,所得溶液中有1Na个O2-
⑥ 1L1mol/L的醋酸溶液中离子总数为2Na
⑦ 标准状况下,22.4L氩气含有原子数为2Na。
⑧ 常温常压下,32gO2、O3的混合物含有2Na个氧原子。
⑨ 1L1mol/L的酒精溶液,含有1Na个分子。
⑩1molFe和足量的盐酸反应,失去3Na个电子。
| A.①②⑤⑦⑧ | B.②④⑥⑧⑩ | C.⑧⑩ | D.⑧ |
D

①错,在熔融条件下,它的电离方式是可KHSO4=K+ + HSO4-,阳离子只有K+,为0.05NA个。
②错,HCl在溶液中全部电离,没有HCl分子存在。
③错,常温常压下,11.2L的CH4中,CH4物质的量不等于0.5mol,
④错,过氧化钠和水反应是歧化反应,一半的得电子,一半失电子,转移0.1NA的电子
⑤错,O2-在溶液中不存在,
⑥错,醋酸是弱电解质,不可能完全电离,离子总数小于2Na
⑦错,氩是单原子分子,1mol氩气含有原子数为1Na
⑧正确,32gO2、O3的混合物,可以理解是32g氧原子,n(O)=32g/16g/mol=2mol
N(O)=2NA,质量和物质的量关系,与温度压强没有关系。常温常压下容易产生误导
⑨错,1L1mol/L的酒精溶液,应该包括水分子和酒精分子,
⑩错,Fe和盐酸反应生成Fe2+,1molFe和足量的盐酸反应,失去2Na个电子
②错,HCl在溶液中全部电离,没有HCl分子存在。
③错,常温常压下,11.2L的CH4中,CH4物质的量不等于0.5mol,
④错,过氧化钠和水反应是歧化反应,一半的得电子,一半失电子,转移0.1NA的电子
⑤错,O2-在溶液中不存在,
⑥错,醋酸是弱电解质,不可能完全电离,离子总数小于2Na
⑦错,氩是单原子分子,1mol氩气含有原子数为1Na

⑧正确,32gO2、O3的混合物,可以理解是32g氧原子,n(O)=32g/16g/mol=2mol
N(O)=2NA,质量和物质的量关系,与温度压强没有关系。常温常压下容易产生误导

⑨错,1L1mol/L的酒精溶液,应该包括水分子和酒精分子,
⑩错,Fe和盐酸反应生成Fe2+,1molFe和足量的盐酸反应,失去2Na个电子


练习册系列答案
相关题目
 (1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量
(1)一个12C原子的质量 (2)阿伏加德罗常数(NA) (3)摩尔质量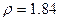 )硫酸的物质的量浓度 (7)44gCO2所含的分子个数
)硫酸的物质的量浓度 (7)44gCO2所含的分子个数