题目内容
常温下,下列溶液中的微粒浓度关系正确的是( )
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D.0.1 mol·L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+) |
CD
解析试题分析:新制氯水中加入氢氧化钠后,反应所得溶液中有电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;碳酸氢钠溶液显碱性,说明水解大于电离,所以水解产生的c(H2CO3) 大于电离产生的c(CO32-),故B错误;NH4Cl与氨水的混合溶液呈中性,则c(OH-)=c(H+),因此必然有c(Cl-)=c(NH),C正确;CH3COONa溶液有质子守恒c(OH-)=c(CH3COOH)+c(H+),故D正确;故选CD。
考点:本题考查的混合溶液中离子浓度大小的比较。

练习册系列答案
相关题目
下列说法正确的是
| A.c(H+)>c(OH一)的溶液一定显酸性 |
| B.常温下,pH=6的溶液一定是酸溶液 |
| C.电解稀硫酸或氢氧化钠溶液的产物不同 |
| D.水电解生成氢气和氧气,证明水是弱电解质 |
下列溶液一定显酸性的是
| A.含H+的溶液 |
| B.c(OH-)<c(H+)的溶液 |
| C.pH<7的溶液 |
| D.能与金属Al反应放出H2的溶液 |
下列各步制取物质,最终无法达到目的的有( )
A.Al Al2O3 Al2O3 Al(NO3)3 Al(NO3)3 Al2O3 Al2O3 |
B.Cu CuO CuO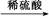 CuSO4溶液 CuSO4溶液 CuSO4·5H2O CuSO4·5H2O |
C.Fe FeCl3 FeCl3 Fe(OH)3 Fe(OH)3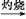 Fe2O3 Fe2O3 |
D.FeSO4溶液 FeS FeS FeS FeS |
下列说法正确的是( )
| A.难溶电解质作比较时,Ksp小的,溶解度一定小 |
| B.Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀溶解平衡会发生移动 |
| C.所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去 |
| D.温度一定,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液 |
下列反应不属于水解反应或水解方程式不正确的是( )
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O CO32-+H3O+
CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
| A.①②③④ | B.①②③ |
| C.①②⑤ | D.全部 |
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅
黄色沉淀。对上述过程,下列理解或解释中正确的是( )
| A.Ksp(AgCl)<Ksp(AgBr) |
| B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀 |
| C.上述实验说明AgCl没有NaBr稳定 |
| D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解 |
一定温度下,向0.1 mol·L-1 CH3COOH溶液中加少量水,下列有关说法错误的是( )
| A.溶液中所有离子的浓度都减小 |
| B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 |
| D.溶液的pH增大 |

 H+ + A2-
H+ + A2-