题目内容
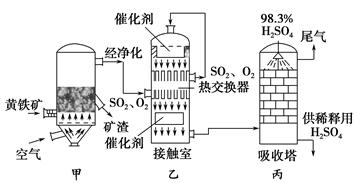
在硫酸的工业制法中,下列生产操作及对采取此操作的主要原因的叙述都正确的是()
| A.硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧 |
| B.沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应 |
| C.SO2氧化为SO3时,使用催化剂可以提高硫酸的产率 |
| D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全 |
D
试题分析:硫铁矿燃烧前需要粉碎的目的是增大反应物的接触面积,加快反应速率,A不正确;B不正确,杂质能使催化剂中毒,B不正确;催化剂不能改变平衡状态,所以C不正确,因此正确的答案选D。
点评:化工生产是以化学反应原理为依据,以实验室研究为基础,任何生成的完成都要符合化学反应规律。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题: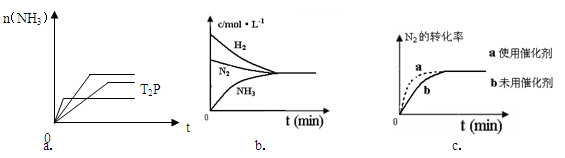
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。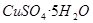 。
。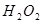 溶液,稍加热。
溶液,稍加热。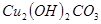 粉末至
粉末至 为
为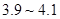 。
。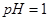 。
。
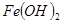
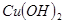
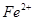 氧化为
氧化为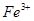 的目的是 。
的目的是 。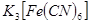 (铁氰化钾)验证II中
(铁氰化钾)验证II中
 压强
压强 的空气是为了________。
的空气是为了________。