题目内容
10.氯、溴、碘三种卤素单质的化学性质相似.其原因是( )| A. | 颜色相似 | B. | 都是双原子分子 | ||
| C. | 最外层电子数相同,都是7 | D. | 自然界中都以化合态存在 |
分析 元素的化学性质取决于该元素原子的最外层电子数,同主族元素具有相似的化学性质.
解答 解:元素的化学性质取决于该元素原子的最外层电子数,同主族元素具有相似的化学性质是因为其最外层电子数相等,与其单质分子构成、颜色、自然界的存在状态等因素都无关,故选C.
点评 本题考查了原子结构和元素化学性质的关系,明确元素性质与其最外层电子数之间的关系即可解答,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
20. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
(1)①由表中数据可知该反应为放热反应,理由是随温度升高,反应的平衡常数减小.
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂 c.升高温度 d.及时分离出产物中的NH3
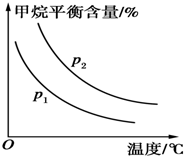
(2)原料气H2可通过反应CH4(g)+H2O(g)?CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1<p2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2(g)+H2 (g)获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5L的容器中进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应N2+3H2?2NH3的平衡常数K值和温度的关系如下:| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号).
a.增大压强 b.使用合适的催化剂 c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)?CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是p1<p2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2(g)+H2 (g)获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5L的容器中进行反应,下列描述能够说明体系处于平衡状态的是cd(填字母序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
18.下列叙述不正确的是( )
| A. | 氨水中:c(NH3•H2O)>c(NH${\;}_{4}^{+}$)>c(OH-) | |
| B. | 饱和H2S溶液中:c(H2S)>c(H+)>c(HS-)>c(S2-) | |
| C. | 0.1mol/LCH3COOH溶液中:c(H+)-c(OH-)=c(CH3COO-) | |
| D. | NaOH溶液中:c(H+)+c(Na+)=c(OH-) |
5.下列说法中正确的是( )
| A. | 分子式为C5H12的烷烃,含有3个甲基结构的同分异构体有2种 | |
| B. | 丙烯能发生加成反应,还能使酸性KMnO4溶液褪色 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
15.下列实验操作正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏时,应使温度计水银球伸入蒸馏烧瓶内液面下 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
19. “人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
“人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 “人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
“人工树叶”电化学实验装置如图,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置工作时,光能和电能全部转化为化学能 | |
| B. | 该装置工作时,H+向b极板移动 | |
| C. | 反应6CO2+8H2O$\frac{\underline{\;\;\;光\;\;\;}}{通电}$2C3H8O+9O2,每消耗1 mol CO2 转移4 mol电子 | |
| D. | 电极a上CO2参与的电极反应为:3CO2+18H++18e-═C3H8O+5H2O |
20.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法正确的是( )
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
