题目内容
【题目】实验室里需用490 mL 0.5 mol·L-1的CuSO4溶液。
(1)该同学应选择________ mL的容量瓶。
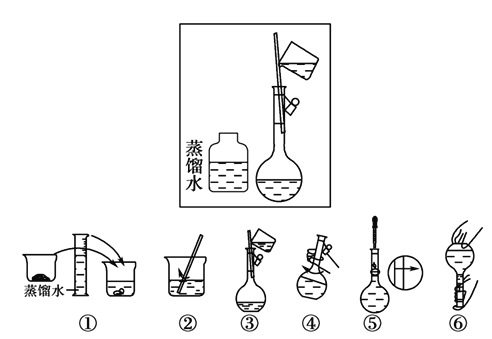
(2)某操作步骤如下图方框所示,则该图表示的操作应放在下图序号所示的_______和_______(填序号)操作之间。
(3)实验室可以提供三种试剂:①CuSO4固体②CuSO·5H2O ③10mol·L-1CuSO4溶液,若该同学用②来配制上述所需CuSO4溶液,应称取试剂②的质量是___________;若该同学用③来配制上述所需CuSO4溶液,应量取试剂③的体积是____________。
(4)下列溶液配制过程中能造成浓度偏低的操作有(填写序号)_________。
a.转移完溶液后未洗涤玻璃棒和烧杯
b.容量瓶用蒸馏水洗涤后残留有少量的水
c.用CuSO固体配制溶液,称量时发现部分固体颜色变蓝
d.进行(2)中图②操作时有部分液体溅到烧杯外边
e.定容时俯视刻度线
f.摇匀后发现液面低于刻度线,没进行其他操作
【答案】500 ④ ⑤ 62.5 g 25 ml a c d
【解析】
根据配制一定物质的量浓度的溶液过程,选择合适容量瓶、进行有关计算、分析实验误差。
(1)常用容量瓶的规格有100mL、250mL、500mL、1000mL。配制490 mL 溶液应选择500mL容量瓶,即只能配制500mL溶液。
(2)方框为定容的前期操作:引流加蒸馏水,操作④为洗涤液转入容量瓶后的摇匀,操作⑤为定容的后期操作:边滴加蒸馏水、边观察液面。故方框所示操作应在④、⑤之间。
(3)若以试剂②配制上述CuSO4溶液时,m(CuSO4·5H2O)=0.500L ×0.5 mol·L-1×250g·mol-1=62.5g。若以③配制上述CuSO4溶液时,所需③的体积V=0.500L ×0.5 mol·L-1÷10mol·L-1=0.025L=25mL。
(4)a.转移完溶液后的玻璃棒和烧杯附着有少量溶液,未洗涤即损失了溶质,使浓度偏低;
b.配制溶液过程中需向容量瓶中加水定容,故洗涤容量瓶后残留的少量水,不影响所配溶液浓度;
c.用CuSO固体配制时,部分固体颜色变蓝使称得的CuSO减少,所配溶液浓度偏低;
d.(2)中图②操作为固体溶解或浓溶液稀释,部分液体溅到烧杯外,即损失溶质,使浓度偏低;
e.定容时俯视刻度线,则凹液面最低处低于刻度,溶液体积偏小,浓度偏高;
f.摇匀时少量液体附着于刻度上面的内壁,使液面低于刻度线。这是正常现象,不影响所配溶液浓度;
综上,造成浓度偏低的操作有a、c、d。

【题目】下列各项中的物质,能满足如图中阴影部分关系的
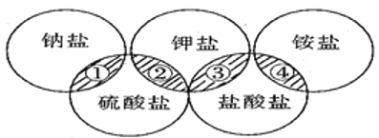
选项 | ① | ② | ③ | ④ |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | NaCl | K2SO4 | KCl | NH4Cl |
C | Na2SO4 | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A. A B. B C. C D. D


