题目内容
实验室里常利用反应: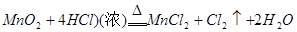 来制取氯气。当有17.4g
来制取氯气。当有17.4g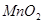 完全反应时,计算:
完全反应时,计算:
(1)生成的氯气在标准状况时的体积。
(2)被氧化的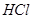 的物质的量。
的物质的量。
(1)4.48L(2分)
(2)0.4mol(2分
解析试题分析:(1)n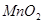 =17.4g/87g/mol
=17.4g/87g/mol
=0.2mol
ncl2=n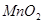 =0.2mol
=0.2mol
V=4.48L
(2)被氧化的氯化氢的物质的量是氯气物质的量的2倍。所以
nHcl=0.4mol
考点:本题是考查物质的量的有关计算。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
设NA为阿伏加德罗常数的值,下列有关叙述正确的是 ( )
| A.28g乙烯所含共用电子对数目为4NA |
| B.0.5 mol 1, 3-丁二烯分子中含有C=C双键数为 NA |
| C.1 mol羟基所含的电子总数为10NA |
| D.标准状况下,11.2 L己烷所含分子数为0.5 NA |
下列化学用语使用正确的组合是
A.Mg2+结构示意图: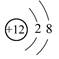 |
B.含18个中子的氯原子的核素符号: Cl Cl |
C.NH4Cl的电子式: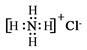 |
D.四氯化碳分子球棍模型:  |
同温同压下,等质量的SO2气体和SO3气体相比较,下列叙述中正确的是( )
| A.密度比为4:5 | B.物质的量之比为4:5 |
| C.体积比为1:1 | D.原子数之比为3:4 |
设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B.标准状况下,22.4L水的分子数为NA |
| C.将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为NA |
| D.1mol/LK2SO4溶液所含K+数目为2NA |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的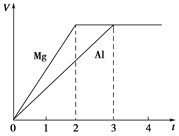
| A.物质的量之比为3∶2 |
| B.质量之比为3∶2 |
| C.摩尔质量之比为2∶3 |
| D.反应速率之比为2∶3 |
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A.标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA |
| B.56g的铁发生氧化还原反应,一定失去3NA个电子 |
| C.标准状况下,22.4L氟气中所含氟原子数为2NA |
D.0.1mol·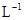 稀硫酸中含有 稀硫酸中含有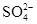 离子数为0.1NA 离子数为0.1NA |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为( ) 
| A.(V2-V1)V1 | B.V1/V2 |
| C.V1/(V2-V1) | D.V2/V1 |
使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl—离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比是( )
| A.9:3:1 | B.3:2:1 | C.6:3:2 | D.9:4:1 |