题目内容
13.某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如图所示的简单操作流程: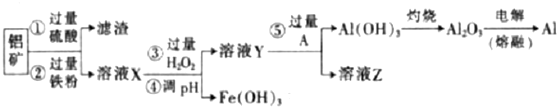
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | AlOH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)滤渣主要成分的化学式为Cu、Fe、SiO2.
(2)灼烧Al(OH)3时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有坩埚(填仪器名称).
(3)溶液Y中要加入稍过量原料A,原料A的化学式是NH3•H2O.
(4)操作流程中③的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(5)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如下图所示:

请写出该电池正极反应式Ag2O+2e-+H2O=2Ag+2OH-.
分析 该工艺流程原理为:氧化铜铝矿加入工业废酸,溶解氧化铜、氧化铝,加入过量铁粉,除去溶液中铜离子,过滤,滤渣中主要为Cu、Fe、SiO2等,滤液X中含有铝离子、亚铁离子,再加入过氧化氢,将亚铁离子氧化为铁离子,通过调节PH值,使铁离子转化为氢氧化铁而除去,溶液Y含有铝离子等,加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝生成金属铝,溶液Z主要含有硫酸铵,据此答题;
解答 解:该工艺流程原理为:氧化铜铝矿加入工业废酸,溶解氧化铜、氧化铝,加入过量铁粉,除去溶液中铜离子,过滤,滤渣中主要为Cu、Fe等,滤液X中含有铝离子、亚铁离子,再加入过氧化氢,将亚铁离子氧化为铁离子,通过调节PH值,使铁离子转化为氢氧化铁而除去,溶液Y含有铝离子等,加入氨水,将铝离子转化为氢氧化铝沉淀,加热分解得氧化铝,电解氧化铝生成金属铝,溶液Z主要含有硫酸铵,
(1)根据上面的分析可知,滤渣主要成分的化学式为Cu、Fe、SiO2,
故答案为:Cu、Fe、SiO2;
(2)灼烧固体用到的硅酸盐质的仪器有玻璃棒、酒精灯、泥三角、坩埚,
故答案 为:坩埚;
(3)根据上面的分析可知,原料A为NH3•H2O,
故答案为:NH3•H2O;
(4)操作流程中③是双氧水将亚铁离子氧化成铁郭,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(5)Al-Ag2O电池中,Al作负极,Ag2O作正极,Ag2O在正极发生还原反应生成银,在碱性电解质中,电极反应式为Ag2O+2e-+H2O=2Ag+2OH-,
故答案为:Ag2O+2e-+H2O=2Ag+2OH-.
点评 本题以冶炼铝为载体,考查学生对工艺流程的理解、对操作的分析评价、盐类水解、原电池、电解池等,理解工艺流程是关键,是对所学知识的综合考查,难度中等.

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
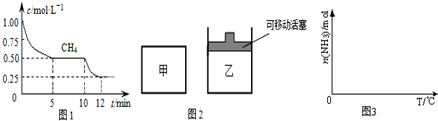
①在一密闭容器中进行上述反应,测得 CH4的物质的量浓度随反应时间的变化如图1所示.反应中处于平衡状态的时间为5min-10min、12min后;10min时,改变的外界条件可能是升高温度.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol?1
①依据温度对合成氨反应的影响,在如图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
②根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
| A. | 同种元素的质子数必定相同 | |
| B. | 不同元素原子的质量数必定不同 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | 凡是核外电子数相同的微粒必定属于同一元素 |
| A. | 2014年诺贝尔化学奖授予发明超分辨率荧光显微镜的科学家,他们使光学显微镜分辨率提高到纳米尺度.利用超分辨率荧光显微镜可以观测到胶体中的胶粒 | |
| B. | 燃料电池的制作:用包有薄海绵的两根碳棒做电极电解Na2SO4溶液,一段时间后切断电源在两极之间接上发光二极管,发现二极管发光 | |
| C. | 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 人体从食物中摄取蛋白质,在体内先水解成各种氨基酸,经过不断的分解,最终生成水和二氧化碳排出体外 |
| A. | 1mol | B. | 2mol | C. | 2.5mol | D. | 10mol |
| A. | 3a% | B. | 6a% | C. | 大于3a% | D. | 小于3a% |
| A. | 3Zn+8HNO3(稀)═3 Zn (NO3)2+2NO↑+4H2O | |
| B. | CuO+2 HNO3 (稀)═Cu(NO3)2+H2O | |
| C. | C+4HNO3 (浓)═CO2+4 NO2↑+2H2O | |
| D. | 3Ag+4 HNO3 (稀)═3 Ag NO3+NO↑+2H2O |
 (1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为
(1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为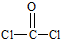 ,其中碳氧原子之间共价键是c(填序号).
,其中碳氧原子之间共价键是c(填序号).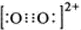 .
.