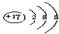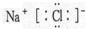题目内容
氯是富含在海水中的元素,下列关于氯及其化合物的说法不正确的是( )A.氯元素位于周期表中第三周期第ⅦA族
B.Cl-结构示意图为:
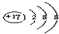
C.NaCl电子式为
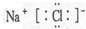
D.KClO3电离方程式为:KClO3=K++Cl-+3O2-
【答案】分析:A.根据Cl的原子序数结合核外电子排布判断在周期表中的位置;
B.Cl-原子核外有18的电子,最外层为8电子稳定结构;
C.NaCl为离子化合物,阳离子与阴离子之间以离子键相结合;
D.KClO3电离出K+和ClO3-.
解答:解:A.Cl原子序数为17,原子核外有3个电子层,最外层电子数为7,位于第三周期第ⅦA族,故A正确;
B.Cl-原子核外有18的电子,最外层为8电子稳定结构,结构示意图为: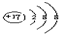 ,故B正确;
,故B正确;
C.NaCl为离子化合物,电子式为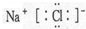 ,故C正确;
,故C正确;
D.KClO3电离出K+和ClO3-,KClO3电离方程式为KClO3=K++ClO3-,故D错误.
故选D.
点评:本题考查较为综合,但难度不大,注意把握原子结构、化学键以及电离方程式的书写,为化学用语中常考查内容.
B.Cl-原子核外有18的电子,最外层为8电子稳定结构;
C.NaCl为离子化合物,阳离子与阴离子之间以离子键相结合;
D.KClO3电离出K+和ClO3-.
解答:解:A.Cl原子序数为17,原子核外有3个电子层,最外层电子数为7,位于第三周期第ⅦA族,故A正确;
B.Cl-原子核外有18的电子,最外层为8电子稳定结构,结构示意图为:
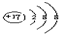 ,故B正确;
,故B正确;C.NaCl为离子化合物,电子式为
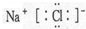 ,故C正确;
,故C正确;D.KClO3电离出K+和ClO3-,KClO3电离方程式为KClO3=K++ClO3-,故D错误.
故选D.
点评:本题考查较为综合,但难度不大,注意把握原子结构、化学键以及电离方程式的书写,为化学用语中常考查内容.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
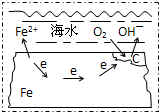 (2008?闵行区模拟)图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )
(2008?闵行区模拟)图表示的是钢铁在海水中的锈蚀过程,以下有关说法正确的是( )