题目内容
【题目】已知A、B、C、D、E、G、H、I均为气体,G可使湿润红色石蕊试纸变蓝,J为常见的液态物质,A、B、C、I、M为单质,且M为常见金属,G和H相遇时产生白烟,它们存在如图的转化关系(图中部分反应物或产物已省略),请回答有关问题:
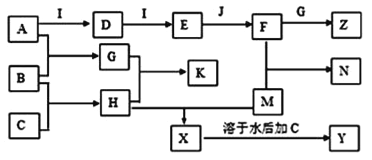
(1)请写出:A物质的化学式:___;
(2)①写出实验室用K制取G的化学方程式_______;
②实验室检验气体G是否收集满的方法:__________;
③G与H相遇可生成白烟K,请写出该反应的化学方程式______.
(3)①F的浓溶液与木炭反应的化学方程式为____________;
②工业F的浓溶液呈黄色,试用化学方程式解释原因:_________;若要消除黄色可向其中通入一定量的_____.
【答案】 N2 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 用湿润的红色石蕊试纸靠近于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满 NH3+HCl═NH4Cl C+4HNO3(浓)
CaCl2+2NH3↑+2H2O 用湿润的红色石蕊试纸靠近于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满 NH3+HCl═NH4Cl C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O 4HNO3(浓)
CO2↑+4NO2↑+2H2O 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O 氧气
4NO2↑+O2↑+2H2O 氧气
【解析】已知A、B、C、D、E、G、H、I均为气体,A、B、C、I、M为单质,G可使湿润红色石蕊试纸变蓝,则G为NH3,G和H相遇时产生白烟,则H为HCl,则K为NH4Cl,B和C能生成H,则C为Cl2,B为H2,A为N2,J为常见的液态物质,则J为H2O,根据转化关系可知,I为O2,D为NO,E为NO2,F为HNO3,Z为NH4NO3,M为常见金属,M能与盐酸反应后又与氯气反应,所以M为Fe,所以X为FeCl2,Y为FeCl3;
(1)由以上分析可知A为为N2;
(2)①实验室用氯化铵制取氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②实验室检验气体氨气是否收集满的方法是用湿润的红色石蕊试纸靠近于集气瓶口,如果红色石蕊试纸变蓝,则说明收集满;
③氯化氢遇到氨气生成氯化铵,出现白烟,反应的化学方程式为NH3+HCl═NH4Cl;
(3)①F为HNO3,F的浓溶液与木炭反应的化学方程式为C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
②工业浓硝酸溶液呈黄色,是因为浓硝酸分解产生二氧化氮,反应方程式为:4HNO3(浓)![]() 4NO2↑+O2↑+2H2O,若要消除黄色可向其中通入一定量的氧气。
4NO2↑+O2↑+2H2O,若要消除黄色可向其中通入一定量的氧气。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案


