题目内容
【题目】A~G七种物质的转化关系如图所示(部分反应物、产物和反应条件未标出)。其中,A、B为中学化学常见的金属单质,C是淡黄色固体,D既能与强酸溶液反应,又能与强碱溶液反应,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,E和G焰色反应均呈黄色。①、④、⑤均为燃烧反应。
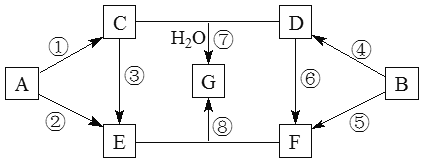
请回答下列问题:
(1)F的化学式 ,G的化学式 。
(2)反应①的化学方程式是 。
(3)写出下列反应的离子方程式:
③ ,⑥ 。
(4)将E的溶液逐滴加入到F的溶液中至过量,其现象是 , 。
【答案】
(1)AlCl3;NaAlO2;
(2)2Na+O2![]() Na2O2;
Na2O2;
(3)2Na2O2+2H2O=4Na++4OH-+O2↑;Al2O3+6H+=2Al3++3H2O;
(4)先产生白色胶状沉淀,最后沉淀逐渐溶解;Al3++4OH-=AlO-2+2H2O;
【解析】
试题分析:C是淡黄色固体,应为Na2O2,则A为Na,E含有3种元素,应为NaOH,由钠和水反应生成,D既能与强酸溶液反应,又能与强碱溶液反应,应为Al2O3,则B为Al,F溶液中加入AgNO3溶液产生不溶于稀硝酸的白色沉淀,应生成AgCl,说明F为AlCl3,由转化关系可知G为NaAlO2。
(1)由以上分析可知F为AlCl3,G为NaAlO2,故答案为:AlCl3;NaAlO2;
(2)反应①是钠与氧气加热反应生成过氧化钠,化学方程式为2Na+O2![]() Na2O2,故答案为:2Na+O2
Na2O2,故答案为:2Na+O2![]() Na2O2;
Na2O2;
(3)反应③的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,反应⑥的离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑; Al2O3+6H+=2Al3++3H2O;
(4)E为NaOH,F为AlCl3,将E的溶液逐滴加入到F的溶液中至过量,发生的反应依次为Al3++3OH-= Al(OH)3,Al(OH)3 + OH-= AlO2-+2H2O,现象是先产生白色胶状沉淀,最后沉淀逐渐溶解,总反应离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:先产生白色胶状沉淀,最后沉淀逐渐溶解;Al3++4OH-=AlO2-+2H2O。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | NaCl(Na2CO3) | 稀硫酸 | 蒸发结晶 |
B | CO2(CO) | O2 | 点燃 |
C | Zn(Ag) | 稀盐酸 | 过滤 |
D | 自来水(Cl-) | ________ | 蒸馏 |
【题目】
(1)用托盘天平称取NaOH固体____________g。称量NaOH固体需注意:因NaOH具有腐蚀性,在称量时需用烧杯盛装NaOH固体;称量必须迅速,其原因是_________________________。
(2) 接下来完成此实验你将用到的仪器有玻璃棒、烧杯、_________________。
而某同学提出只需再选择带刻度的500 mL烧杯和玻璃棒,即可配制500 mL 0.10 mol/L的NaOH溶液;你对此方案的评价是_______________________。
(3) 若你从所配的溶液中取出50 mL于一试剂瓶中,请给它贴上标签,标签的内容是_________;
若再从中取出10 mL溶液加水稀释至20 mL,则此时溶液的物质的量浓度为____________。
(4) 下列操作对所配溶液浓度没有影响的是_______。
A.称量时已观察到NaOH表面潮湿 |
B.将烧杯中溶解后的溶液立即注入容量瓶,然后再添加蒸馏水至刻度线 |
C.摇匀定容后,又用胶头滴管向容量瓶中滴加蒸馏水至刻度线 |
D.配制溶液前用蒸馏水润洗容量瓶,但未烘干 |
