题目内容
15.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、Ag+、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、OH-、NO3-、Cl- |
分析 无色可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,碱性溶液中存在大量氢氧根离子,
A.高锰酸根离子为有色离子,不满足溶液无色的条件;
B.银离子与氢氧根离子、碳酸根离子反应;
C.氢离子与氢氧根离子反应;
D.该组离子之间不反应.
解答 解:无色可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,碱性溶液中存在大量氢氧根离子,
A.MnO4-为有色离子,不满足溶液无色的要求,故A错误;
B.Ag+与OH-、CO32-之间发生反应,在溶液中不能大量共存,故B错误;
C.H+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Na+、OH-、NO3-、Cl-之间不反应,都不与氢氧根离子反应,且为无色溶液,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
10.下列离子方程式正确的是( )
| A. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 过量的氯气通入溴化亚铁溶液中:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | |
| C. | 次氯酸钠溶液中加入少量硫酸亚铁溶液:Fe2++2ClO-+H2O=Fe(OH)2↓+2HClO | |
| D. | NaHCO3溶液与过量Ba(OH)2溶液混合:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O |
20.根据反应式:(1)2A3++2B-═2A2++B2,(2)C2+2A2+═2A3++2C-,可判断离子的还原性从强到弱的顺序是( )
| A. | C-、A2+、B- | B. | B-、A2+、C- | C. | C-、B-、A2+ | D. | A2+、B-、C- |
7.下列工业生产,需用碳酸钙作为原料之一的( )
①用海水为原料生产镁,②制硅酸盐水泥,③制普通玻璃,④冶炼生铁,⑤制漂白粉.
①用海水为原料生产镁,②制硅酸盐水泥,③制普通玻璃,④冶炼生铁,⑤制漂白粉.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①②③⑤ | D. | ①②③④ |
4.下列各组中两种溶液的反应,可用同一离子方程式表示的是( )
| A. | 盐酸与碳酸钙;盐酸与碳酸钠 | |
| B. | 硝酸银与盐酸;硝酸银与氯化钠 | |
| C. | 氯化钡与硫酸钠;氢氧化钡与硫酸 | |
| D. | 氢氧化钾与硫酸镁;氢氧化钡与硫酸镁 |
5.下列物质在水中不能够完全电离的是( )
| A. | Fe(OH)3 | B. | HNO3 | C. | NaOH | D. | NaCl |
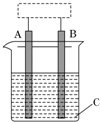 某课外化学兴趣小组设计了如图所示装置(虚框内部分未画出),在装置内起初发生的反应为:Cu+H2SO4═H2↑+CuSO4
某课外化学兴趣小组设计了如图所示装置(虚框内部分未画出),在装置内起初发生的反应为:Cu+H2SO4═H2↑+CuSO4
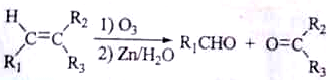

 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O
 .
.