题目内容
7.室温下,三种中学化学常见的单质A、B、C分别为固体、黄绿色气体、无色气体,在一定条件下它们的反应如图: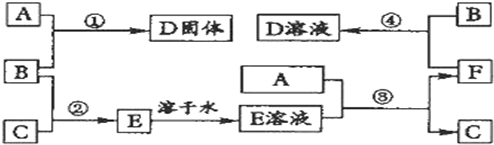
(1)C的分子式为H2,它在充满B气体的集气瓶中燃烧时的现象是:剧烈燃烧,苍白色火焰
(2)写出反应①的化学方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$ 2FeCl3
(3)分别写出③和④的离子方程式Fe+2H+═Fe2++H2 ↑,2Fe2++Cl2=2Fe3++2Cl-
(4)D、E、F三种物质的水溶液中均含有一种相同的主要阴离子是Cl-,检验该阴离子所用的试剂是硝酸酸化的AgNO3溶液.
分析 B是黄绿色气体,故B是氯气,A和B生成D,D是氯化物,D溶于水得黄色溶液,D含有铁离子,则D是氯化铁,A是铁,氯气和C反应生成E,E溶于水得无色溶液,无色溶液和A反应,生成F和C,则C是氢气,E是氯化氢,铁与盐酸反应生成F为氯化亚铁,据此答题.
解答 解:B是黄绿色气体,故B是氯气,A和B生成D,D是氯化物,D溶于水得黄色溶液,D含有铁离子,则D是氯化铁,A是铁,氯气和C反应生成E,E溶于水得无色溶液,无色溶液和A反应,生成F和C,则C是氢气,E是氯化氢,铁与盐酸反应生成F为氯化亚铁,
(1)通过以上分析知,C是氢气,C的化学式为H2,氢气在充满氯气体的集气瓶中燃烧时的现象是剧烈燃烧,苍白色火焰,
故答案为:H2;剧烈燃烧,苍白色火焰;
(2)反应①的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)反应③的离子方程式为Fe+2H+═Fe2++H2 ↑,反应④是氯气和氯化亚铁溶液反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2H+═Fe2++H2 ↑,2Fe2++Cl2=2Fe3++2Cl-;
(4)D是氯化铁,E是氯化氢,F为氯化亚铁,三种物质的水溶液中均含有一种相同的主要阴离子是 Cl-,检验Cl-离子所用的试剂是硝酸酸化的AgNO3溶液,
故答案为:Cl-;硝酸酸化的AgNO3溶液.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,能正确推断元素化合物是解本题的关键,注意氯离子的检验是高考的热点,铁在氯气中燃烧时,无论铁是否过量都生成氯化铁,为易错点,题目难度中等.

| A. | 150 mL 1 mol/L的NaCl溶液 | B. | 75 mL 2 mol/L的NH4Cl溶液 | ||
| C. | 150 mL 3 mol/L的KCl溶液 | D. | 75 mL 1 mol/L的BaCl2溶液 |
| A. | 18K金 | B. | 青铜 | C. | 钢 | D. | 水银 |
| A. | 1molFe和足量的足量的氯气完全反应,共失去3mol电子 | |
| B. | 含NA个氧原子的氧气在标准状况下的体积为11.2L | |
| C. | 1molNa原子中约含有11NA个电子 | |
| D. | 1个氢气分子的实际重量约为$\frac{1}{{N}_{A}}$g |
| A. | 能在水溶液或熔融状态下导电的物质就是电解质 | |
| B. | 胶体是一种能产生丁达尔效应的分散系 | |
| C. | 纯碱不属于碱,干冰属于酸性氧化物 | |
| D. | Na2O和Na2O2都能与水反应生成对应的碱,它们都是碱性氧化物 |
| A. | 胶体区别于其他分散系的本质特征是分散质微粒直径在10-9~10-7m之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体时,均能产生丁达尔现象 | |
| C. | 向豆浆中加入盐卤做豆腐是胶体聚沉在生活中的具体应用 | |
| D. | 溶液、胶体、浊液均属于混合物 |
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ① |
| A. | 大理石与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 将少量铜片放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 向澄清石灰水中加入过量的小苏打溶液:OH-+HCO3-+Ca2+═CaCO3↓+H2O |