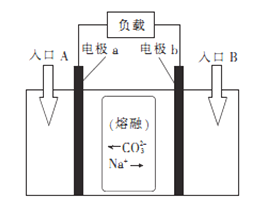
题目内容
【题目】【上海市闵行区2017届高三上学期期末教学质量调研(一模)】
利用海水可以提取氯化钠、溴、碘等产品。海带提碘的流程如下:
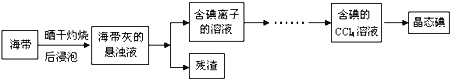
(1)CCl4含有___________键的______________分子(均选填“极性”或“非极性”)。
(2)灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是____________。
(3)为更好的完成实验,灼烧海带时,需加入一定量的氢氧化钠充分混合后再灼烧。此操作目的是___________________________________。
(4)向盛有碘离子溶液中加入CCl4和氯水,______(填:“上”或“下”)层呈紫红色;如果氯水加过量,CCl4层会由紫红色变成无色。整个过程中被氧化的微粒是__________________。写出并配平CCl4层由紫红色变成无色的化学反应方程式:__________
![]()
【答案】极性 非极性 坩埚、玻璃棒 坩埚钳 (写对两个即可) 灼烧时碘离子易被空气中氧气氧化成为I2而挥发,有氢氧化钠时I2会转化成为无机盐,能减少碘的挥发 下 I2、I- I2+5Cl2+6 H2O→2HIO3+10HCl
【解析】(1)四氯化碳是空间正四面体,为非极性分子,共价键为极性键;(2)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三角支撑,然后放在三脚架上,三脚架下面的空间放酒精灯,加热时用玻璃棒搅拌,取用坩埚用坩埚钳,灼烧海带时除需要三脚架、酒精灯、泥三角外,还需要的主要仪器是坩埚、玻璃棒、坩埚钳;(3)碘易与NaOH溶液反应,可加入一定量的氢氧化钠充分混合后再灼烧,有氢氧化钠时I2会转化成为无机盐,可减少碘的损失;(4)氯气氧化碘离子为碘单质,碘单质易溶于四氯化碳,四氯化碳不溶于水比水重,分层后在下层,向盛有碘离子溶液中加入CCl4和氯水,下层呈紫红色,如果氯水加过量,CCl4层会由紫红色变成无色是氯气氧化碘单质为碘酸,整个过程中被氧化的微粒是I2、I-,氯气氧化碘单质生成碘酸,本身被还原为氯化氢,反应的化学方程式为:I2+5Cl2+6H2O=2HIO3+10HCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2O![]() CO2(g)+H2(g)得到如下三组数据:
CO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情况表明反应达到平衡状态的是________(填序号)
A. CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
(2)实验2中,反应达到平衡状态时,CO的转化率为__________。
(3)实验3和实验2相比,改变的条件是_____________。
II.(1)硫化钠溶液具有较强碱性,其原因是___________(用离子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 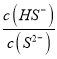 的值增大,可采取的措施是___________(填序号)
的值增大,可采取的措施是___________(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体
【题目】【2017届河北衡水中学全国高三大联考(全国卷)理科综合化学试】
下列操作和现象所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2(g) | 增大压强,平衡逆向移动 |
B | 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 | 原溶液中一定含有Fe3+ |
C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
D | 25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大 | 酸性:H2C2O4<HF |