题目内容
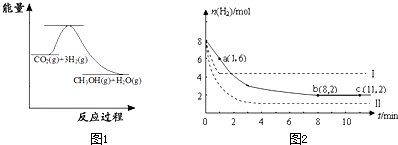
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
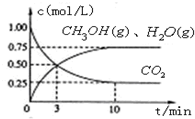
 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
⑴反应开始到平衡,H2的平均反应速率v(H2)=_____mol/(L·min)。H2的转化率为 。
⑵能判断该反应是否达到化学平衡状态的依据是 。
(a)容器中压强不变 (b)混合气体中 C(CO2)=C(H2O)
(c)V正(H2)=3 V逆(H2O) (d)混合气体的密度
(e)混合气体的平均分子量
⑶下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
E.使用催化剂 F.缩小容器体积
⑷反应进行到3分钟时,同种物质的v正 与v逆的关系: v正 v逆 (填>,=,<)
⑸上述反应平衡常数的表达式为 ,经计算该温度下此反应平衡常数的数值为 。
⑹如果上述反应在相同温度和容器中进行,改变起始时加入物质的量,欲使反应达到平衡时CH3OH(g)的体积分数不变,则下列投料理论上合理的是
A.2mol CO2和6mol H2 B.1mol CO2和4mol H2
C.1mol CO2和3mol H2,1molNe
D.0.5mol CO2. 1.5mol H2 0.5mol CH3OH(g) 0.5mol H2O(g)
(1)① 0.225 ( 1分) ; 75% ( 1分)
(2)a c e (3分)
(3) C D F ( 3 分)
(4) > (1分) ;
(5) K=( CCH3OH×CH2O) /( CCO2 ×C3H2 ) (2分) ; 16/3 ( 2 分)
(6) C D(2分)

 科学实验活动册系列答案
科学实验活动册系列答案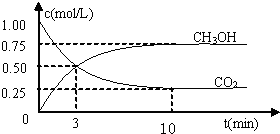 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注