题目内容
有一未知浓度的硫酸溶液25 mL,在加入0.5 mol·L-1 Ba(NO3)2溶液25 mL后,改加NaOH溶液,结果用去1.0 mol·L-1 NaOH溶液50 mL恰好完全中和,则硫酸的物质的量浓度是( )
| A.0.5 mol·L-1 | B.1.0 mol·L-1 | C.1.5 mol·L-1 | D.2.0 mol·L-1 |
B
因为H2SO4+Ba(NO3)2====BaSO4↓+2HNO3,H+并没参加反应,而是加入NaOH溶液时,H+才被中和,故根据:
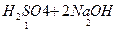 ====2Na2SO4+2H2O,n(H2SO4)=
====2Na2SO4+2H2O,n(H2SO4)=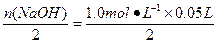 =2.5×10-2 mol,故c(H2SO4)=
=2.5×10-2 mol,故c(H2SO4)=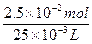 ="1" mol·L-1。
="1" mol·L-1。
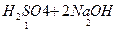 ====2Na2SO4+2H2O,n(H2SO4)=
====2Na2SO4+2H2O,n(H2SO4)=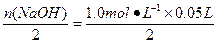 =2.5×10-2 mol,故c(H2SO4)=
=2.5×10-2 mol,故c(H2SO4)=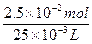 ="1" mol·L-1。
="1" mol·L-1。
练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
 L
L L
L L
L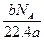 L
L 2PCl3、PCl3+Cl2
2PCl3、PCl3+Cl2
 总数为0.3 NA
总数为0.3 NA