题目内容
【题目】已知反应3NaH+Fe2O3![]() 2Fe+3NaOH。
2Fe+3NaOH。
(1)基态Fe原子核外共有__种运动状态不相同的电子;Fe3+的价电子排布图为__。
(2)1molNaOH含有σ键数目为__;Fe3+可以和SCN-形成配合物,该反应是典型的可逆反应,说明配位原子配位能力__(填“强”或“弱”)。
(3)上述反应中含Na的化合物晶体类型均为__晶体。
【答案】26 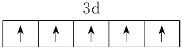 1mol或6.02×1023 弱 离子
1mol或6.02×1023 弱 离子
【解析】
(1)根据泡利不相容原理,核外电子没有任何两个的运动状态是相同的,有多少个核外电子就有多少种不同的运动状态。基态Fe原子核外共有26种运动状态不相同的电子;Fe3+的价电子排布图为![]() 。故答案为:26;
。故答案为:26;![]() ;
;
(2)NaOH中钠离子和氢氧根离子间是离子键,氢氧根离子中氢氧之间是共价键,是σ键,1molNaOH含有σ键数目为1mol或6.02×1023;Fe3+可以和SCN-形成配合物,该反应是典型的可逆反应,说明配位原子配位能力弱。故答案为:1mol或6.02×1023;弱;
(3)3NaH+Fe2O3![]() 2Fe+3NaOH反应中含Na的化合物NaH、NaOH晶体类型均为离子晶体。故答案为:离子。
2Fe+3NaOH反应中含Na的化合物NaH、NaOH晶体类型均为离子晶体。故答案为:离子。

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目