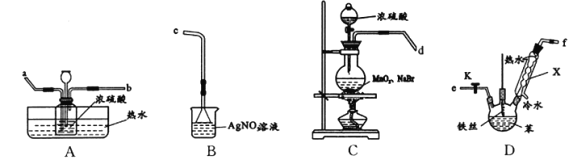
题目内容
【题目】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
①NaCN+HNO2![]() HCN+NaNO2
HCN+NaNO2
②NaCN+HF![]() HCN+NaF
HCN+NaF
③NaNO2+HF![]() HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是 ( )
A.K(HCN)=7.2×10-4
B.K(HCN)<K(HF)<K(HNO2)
C.同浓度的三种盐溶液,pH(NaNO2)<pH(NaF)<pH(NaCN)
D.若已知酸性:CH3COOH<HNO2,则可以发生反应HF+CH3COONa![]() NaF+CH3COOH
NaF+CH3COOH
【答案】D
【解析】
试题分析:酸的电离平衡常数越大,其酸性越强,强酸能和弱酸盐反应生成弱酸,根据NaCN+HNO2═HCN+NaNO2、NaCN+HF═HCN+NaF、NaNO2+HF═HNO2+NaF知,这三种酸的强弱顺序是HF>HNO2>HCN,则HF、HNO2、HCN对应的电离平衡常数分别是:7.2×10-4、4.6×10-4、4.9×10-10;A.通过以上分析知,K(HF)=7.2×10-4,故A正确;B.酸的电离平衡常数越大,其酸性越强,这三种酸的强弱顺序是HF>HNO2>HCN,所以K(HCN)<K(HNO2)<K(HF),故B正确;C.酸的强弱顺序是HF>HNO2>HCN,所以其钠盐的溶液pH大小顺序为NaF<NaNO2<NaCN,故C正确;D.若已知酸性CH3COOH<HNO2,但无法判断HF与CH3COOH酸性强弱,反应HF+CH3COONa![]() NaF+CH3COOH不一定能进行,故D错误;答案为D。
NaF+CH3COOH不一定能进行,故D错误;答案为D。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在以上元素的单质中,化学性质最不活泼的是 。