题目内容
( 12分)除去下表各溶液中含有的少量杂质(括号内)填写下表:
| 物质(杂质) | 除杂质所需试剂 | 离子方程式 |
| Fe2O3(Al2O3) | | |
| FeCl2溶液(FeCl3) | | |
| NaHCO3溶液(Na2CO3) | | |
(试剂各2分,方程式各2分,共12分)物质(杂质) 除杂所需试剂 离子方程式 Fe2O3(Al2O3) NaOH溶液 Al2O3+2OH¯=2AlO2¯+H2O FeCl2溶液(FeCl3) 铁粉 Fe+2Fe3+=3Fe2+ NaHCO3溶液(Na2CO3) CO2气体 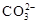 +CO2+H2O=2
+CO2+H2O=2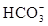
解析

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案(10分)在实验室里可用如图所示装置制取氯酸钾和探究氯水的性质。图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置。请填写下列空白:
⑴制取氯气时,先在烧瓶里加入一定量的二氧化锰,再通过__________ ___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有:①_______________________________________________,
②__________________________________________________________________________。
⑶反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷实验中可观察到③的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为_______色 | ______________________________________ |
(12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
|
滴定次数 |
NaOH溶液体积/mL |
滴定消耗滤液体积/mL[来源: |
|
1 |
25.00 |
20.02 |
|
2 |
25.00 |
17.10 |
|
3 |
25.00 |
19.98 |
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2) 配制成250mL溶液使用的量具是 ,指示剂还可用____________;
(3) 滴定终点的现象是_______________________。
(4) 滤液中溶质的物质的量浓度为_____________。
(5) 若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。 (填“偏高”、“偏低”或“无影响”)